浙江省温州新力量联盟2020-2021学年高二下学期化学期末考试试卷
试卷更新日期:2021-07-02 类型:期末考试
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是 符合题目要求的,不选、多选、错选均不得分)
-
1. 下列物质中,只含有共价键的化合物是( )A、 B、 C、 D、2. 实验室进行石油分馏实验,需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质中属于电解质的是( )A、蔗糖 B、盐酸 C、 D、冰醋酸4. 下列物质与俗名对应不正确的是( )A、 芒硝 B、 :木醇 C、 :消石灰 D、 :肥田粉5. 下列化学用语书写正确的是( )A、丙烯的结构式: B、乙烷的球棍模型
3. 下列物质中属于电解质的是( )A、蔗糖 B、盐酸 C、 D、冰醋酸4. 下列物质与俗名对应不正确的是( )A、 芒硝 B、 :木醇 C、 :消石灰 D、 :肥田粉5. 下列化学用语书写正确的是( )A、丙烯的结构式: B、乙烷的球棍模型 C、 的离子结构示意图:
C、 的离子结构示意图:  D、甲基电子式:
D、甲基电子式:  6. 下列说法正确的是( )A、天然气、水煤气、沼气均属于不可再生的能源 B、煤通过气化、液化等化学变化,可以产生焦炉煤气、煤焦油等物质 C、石油裂化和裂解原理相同,都是将长链烃转化为短链烃 D、苯环之间通过共用苯环的若干条环边而形成的有机物称为联苯7. 下列说法正确的是( )A、 和 互为同位素 B、
6. 下列说法正确的是( )A、天然气、水煤气、沼气均属于不可再生的能源 B、煤通过气化、液化等化学变化,可以产生焦炉煤气、煤焦油等物质 C、石油裂化和裂解原理相同,都是将长链烃转化为短链烃 D、苯环之间通过共用苯环的若干条环边而形成的有机物称为联苯7. 下列说法正确的是( )A、 和 互为同位素 B、 和
和  互为同分异构体
C、 、 、 、 互为同素异形体
D、 和 一定互为同系物
8. 下列说法不正确的是( )A、金属镁的密度小、硬度大,因此被用于制造飞机的部件等 B、 吸收 产生 ,可用作呼吸面具供氧剂 C、水玻璃是建筑行业常用的一种黏合剂和木材的防火剂 D、“火树银花”中的焰火实质上是金属元素的焰色反应9. 下列说法不正确的是( )A、蒸发海水可得到NaCl,电解熔融NaCl可制备Na B、纤维素溶解在铜氨溶液中,然后压入稀酸可得铜氨纤维 C、工业上用软锰矿(主要成分 )与浓盐酸共热制取 D、利用二氧化碳和环氧丙烷可制造全降解塑料10. 反应 中,下列说法正确的是( )A、 中的 元素被氧化 B、 是还原产物 C、氧化剂与还原剂的物质的量之比1:6 D、氧化产物与还原产物的物质的量之比5:111. 下列说法正确的是( )A、 晶体含有少量 杂质,可用溶解、蒸发结晶的方法提纯 B、用移液管移取25.00mL待测液时,若移液管内残留少量液体,必须用洗耳球将其吹出,否则使测量结果偏低 C、用酸性 溶液鉴别苯和甲苯 D、用 溶液鉴别 溶液和 溶液12. 某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到实验目的的是( )A、将表面有铜绿 的铜器放入盐酸中浸泡,除去铜绿 B、将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 C、将 溶液在蒸发皿中加热蒸干,得到无水 固体 D、常温下将铜丝伸入盛满氯气的集气瓶中,观察 的生成13. 正确表示下列变化的离子方程式是( )A、水垢滴加 溶液产生气体: B、打磨的 片和 溶液反应: C、向硫酸铜溶液中加入过量的氨水: D、向 溶液加入少量的 溶液:14. 下列说法不正确的是( )A、医用酒精可以消杀新冠病毒,能使组成病毒的蛋白质变性 B、甲酸、葡萄糖均能在碱性环境下,与新制氢氧化铜反应,生成砖红色沉淀 C、淀粉、纤维素、牛油等天然高分子化合物都是混合物 D、古人粮食酿醋经历了淀粉水解→葡萄糖分解→乙醇氧化的化学变化过程15. 某有机物的结构如图所示,下列关于该有机物的描述正确的是( )
互为同分异构体
C、 、 、 、 互为同素异形体
D、 和 一定互为同系物
8. 下列说法不正确的是( )A、金属镁的密度小、硬度大,因此被用于制造飞机的部件等 B、 吸收 产生 ,可用作呼吸面具供氧剂 C、水玻璃是建筑行业常用的一种黏合剂和木材的防火剂 D、“火树银花”中的焰火实质上是金属元素的焰色反应9. 下列说法不正确的是( )A、蒸发海水可得到NaCl,电解熔融NaCl可制备Na B、纤维素溶解在铜氨溶液中,然后压入稀酸可得铜氨纤维 C、工业上用软锰矿(主要成分 )与浓盐酸共热制取 D、利用二氧化碳和环氧丙烷可制造全降解塑料10. 反应 中,下列说法正确的是( )A、 中的 元素被氧化 B、 是还原产物 C、氧化剂与还原剂的物质的量之比1:6 D、氧化产物与还原产物的物质的量之比5:111. 下列说法正确的是( )A、 晶体含有少量 杂质,可用溶解、蒸发结晶的方法提纯 B、用移液管移取25.00mL待测液时,若移液管内残留少量液体,必须用洗耳球将其吹出,否则使测量结果偏低 C、用酸性 溶液鉴别苯和甲苯 D、用 溶液鉴别 溶液和 溶液12. 某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到实验目的的是( )A、将表面有铜绿 的铜器放入盐酸中浸泡,除去铜绿 B、将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 C、将 溶液在蒸发皿中加热蒸干,得到无水 固体 D、常温下将铜丝伸入盛满氯气的集气瓶中,观察 的生成13. 正确表示下列变化的离子方程式是( )A、水垢滴加 溶液产生气体: B、打磨的 片和 溶液反应: C、向硫酸铜溶液中加入过量的氨水: D、向 溶液加入少量的 溶液:14. 下列说法不正确的是( )A、医用酒精可以消杀新冠病毒,能使组成病毒的蛋白质变性 B、甲酸、葡萄糖均能在碱性环境下,与新制氢氧化铜反应,生成砖红色沉淀 C、淀粉、纤维素、牛油等天然高分子化合物都是混合物 D、古人粮食酿醋经历了淀粉水解→葡萄糖分解→乙醇氧化的化学变化过程15. 某有机物的结构如图所示,下列关于该有机物的描述正确的是( ) A、含有3种官能团 B、一定条件下,该物质可被 催化氧化生成醛基 C、该有机物属于芳香族化合物 D、该物质与足量NaOH溶液反应,生成2种钠盐16. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Q原子半径是同周期最小的,化合物 的电子总数为18个。下列说法不正确的是( )
A、含有3种官能团 B、一定条件下,该物质可被 催化氧化生成醛基 C、该有机物属于芳香族化合物 D、该物质与足量NaOH溶液反应,生成2种钠盐16. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Q原子半径是同周期最小的,化合物 的电子总数为18个。下列说法不正确的是( )Y
Z
M
Q
A、原子半径:Z<Y<M B、M的氢化物沸点一定比Y的氢化物沸点高 C、M与Q元素组成的 分子,空间构型是正四面体 D、 溶液显示碱性17. 室温下,下列说法不正确的是( )A、等浓度、等体积的盐酸和醋酸溶液与足量Zn反应,产生等质量的 B、pH相等的盐酸和醋酸溶液,则 C、 溶液呈酸性,则 一定是强酸 D、若溶液中 ,则溶液一定呈酸性18. 为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下, 与 混合气体中含有 个氧原子 B、 与 盐酸反应,转移的电子数为 C、标准状况下, 含有分子数为 D、标准状况下,22.4L苯中C-H数目为19. 反应 ,在200℃和T℃时,X的物质的量浓度(单位: )随时间变化的有关实验数据见下表:
时间/min
0
2
4
6
8
10
200/℃
0.80
0.55
0.35
0.20
0.15
0.15
T/℃
1.00
0.65
0.35
0.18
0.18
0.18
下列有关该反应的描述正确的是( )
A、在200℃时,4min内用Y表示的化学反应速率为 B、200℃时,第3min时的瞬时速率大于第5min时的瞬时速率 C、T℃下,6min时反应刚好达到平衡状态 D、从表中可以看出T<20020. 含固体混合物 、 、 、 、 、 、 、 中的两种或两种以上化合物,溶于水发生了化学反应,且得到澄清溶液,推测可能存在的物质不合理的是( )A、 、 B、 、 、 C、 、 D、 、21. 氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4倍~5倍,下列有关氯胺( )的说法一定不正确的是( )A、氯胺的水解产物为 (羟氨)和 B、氯胺的电子式为 C、氯胺中氯的化合价为+1
D、氯胺的消毒原理与漂白粉相似
22. 中科院科学家研究开发了一种柔性手机电池,示意图如图所示[其中多硫化锂( )中x=2、4、6、8]。下列说法不正确的是( )
C、氯胺中氯的化合价为+1
D、氯胺的消毒原理与漂白粉相似
22. 中科院科学家研究开发了一种柔性手机电池,示意图如图所示[其中多硫化锂( )中x=2、4、6、8]。下列说法不正确的是( ) A、添加碳纳米层可以提高负极的导电性 B、放电时, 移向 膜 C、电池工作时,正极可能发生: D、电池充电时间越长,电池中 的量越多23. 常温下,将 溶液滴入 溶液的过程中,溶液中由水电离出的 与加入NaOH溶液体积的关系如图所示。下列说法正确的是( )
A、添加碳纳米层可以提高负极的导电性 B、放电时, 移向 膜 C、电池工作时,正极可能发生: D、电池充电时间越长,电池中 的量越多23. 常温下,将 溶液滴入 溶液的过程中,溶液中由水电离出的 与加入NaOH溶液体积的关系如图所示。下列说法正确的是( )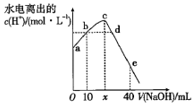 A、 ,a点的纵坐标为 B、b点和d点所示溶液的pH相等 C、滴定过程中, 的比值逐渐增大 D、e点所示溶液中,24. 某反应由两步反应A→B→C构成,它的反应能量曲线如图所示,下列叙述正确的是( )
A、 ,a点的纵坐标为 B、b点和d点所示溶液的pH相等 C、滴定过程中, 的比值逐渐增大 D、e点所示溶液中,24. 某反应由两步反应A→B→C构成,它的反应能量曲线如图所示,下列叙述正确的是( ) A、两步反应均为吸热反应 B、三种化合物中C最稳定 C、第二步反应决定了总反应的速率 D、升高温度,活化能 、 均减小,反应速率加快25. 下列方案设计、现象和结论都正确的是( )
A、两步反应均为吸热反应 B、三种化合物中C最稳定 C、第二步反应决定了总反应的速率 D、升高温度,活化能 、 均减小,反应速率加快25. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
探究 与 反应的限度
将2体积 和1体积 混合通过灼热的 充分反应,产物依次通过 溶液和品红溶液
前者产生白色沉淀,后者褪色, 和 的反应有一定限度
B
检验丙烯醛中是否含有碳碳双键
取少量丙烯醛于试管,加入几滴溴水,观察现象
若溴水褪色,则证明丙烯醛中含有碳碳双键
C
检验乙烯的性质
乙醇与浓硫酸共热至170℃,将产生的气体通入酸性高锰酸钾溶液
若高锰酸钾溶液褪色,说明乙烯具有还原性
D
检验牙膏中是否有甘油
取少量牙膏溶解并取上清液,加入适量新制
若则产生绛蓝色沉淀,则牙膏中含有甘油
A、A B、B C、C D、D二、非选择题(本大题共6小题,共50分)
-
26.(1)、用一个化学方程式说明 与 酸性强弱关系:。(2)、常温下, 在(填“苯”或“水”)中溶解度更大,主要原因是。27. 取8.54g含有 、 、 的固体混合物溶于足量水中,向反应后的试管中逐滴滴加 的盐酸,加入盐酸的体积和沉淀质量的关系如图所示。
 (1)、混合物中 的物质的量至少为mol(2)、X的最大值为mL28. 由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭;
(1)、混合物中 的物质的量至少为mol(2)、X的最大值为mL28. 由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭;B是纯净物;气体D、H所含元素相同;浓硫酸增重3.60g;溶液F焰色反应呈黄色。

请回答:
(1)、组成A的非金属元素是(2)、气体B的结构式(3)、固体A与足量水反应的化学方程式是(4)、若将产生的气体D全部通入溶液E中,恰好被完全吸收,写出该反应的的离子方程式(5)、一定条件下,气体D可能和FeO发生氧化还原反应,设计实验方案验证可能的产物确认该反应是否发生。
29. 含碳物质的转化,有利于“减碳”和可持续性发展,有重要的研究价值。(1)、以 和 为原料合成尿素是利用 的成功范例。在尿素合成塔中的主要反应:反应Ⅰ:
反应Ⅱ:
总反应Ⅲ:
①反应Ⅰ的 kJ/mol。
②一定温度下,恒容的密闭容器中按化学计量数比投料进行反应Ⅲ,下列能说明反应Ⅲ达到化学平
衡状态的是。
A.容器内气体总压强不再变化 B. 与 的浓度相等
C. D. 保持不变
(2)、利用工业废气中的 可以制取甲醇, ,一定条件下往1L的密闭容器中充入 和 ,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内 的转化率随温度变化如(图一)所示:
①b点v(正)v(逆)(填“>”、“<”、“=”)
②温度为 时,该反应的平衡常数K=。
③若某温度下反应已达平衡,下列措施中有利于提高 平衡转化率的是。
A.使用高效催化剂 B.不断分离出产物
C.提高原料气中 的比例 D.升温
(3)、电解法转化 可实现 资源化利用,电解 制CH4的原理如(图二)所示。铜电极上发生的电极反应式是。30. 高锰酸钾( )是常用的氧化剂,工业上以软锰矿(主要成分是 )为原料制备高锰酸钾晶体,中间产物为锰酸钾( ),下图是实验室模拟制备的操作流程:
相关资料:
物质
20℃溶解度
6.4
111
33.7
11.1
217
已知:锰酸钾( )墨绿色结晶,其水溶液呈深绿色。强碱性溶液中稳定,碱性减弱, 发生歧化: ,此方法 转化率较低,理论产率最大只有66.7%。回答下列问题:
(1)、①软锰矿粉粹有利于加快煅烧反应的速率,其理由是②煅烧软锰矿和KOH固体时,选用铁坩埚,用相关的化学方程式说明不采用石英坩埚而的理由是
(2)、①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,出现现象,由此可知反应基本完成。②停止通 ,趁热过滤,将滤液蒸发浓缩至液面出现晶膜、冷却结晶、抽滤、洗涤、干燥得 晶体。下列说法不正确的是()
A、趁热过滤目的是防止 晶体析出而损失
B、将浓缩滤液置于冰水中冷却,可得较大的 晶体颗粒,便于抽滤
C、抽滤时可用玻璃砂漏斗代替布氏漏斗
D、洗涤 晶体应开大水龙头,使洗涤剂快速通过沉淀物
(3)、①通入 对溶液的pH进行调节,控制溶液的pH=10-11,不宜过大或过小,其理由是:②由于 的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通 改为加其他的酸,从理论上分析,选用下列酸中,得到的产品纯度更高()
A.醋酸 B.浓盐酸 C.稀硫酸
31. Tamibarotene(H)用于治疗复发或难治性急性早幼粒细胞白血病,其一种合成路线如下。
已知:

回答下列问题:
(1)、下列说法不正确的是__________A、反应A→B发生加成反应 B、化合物D的分子结构含有2个亚甲基 C、化合物E中无手性碳 D、有机物H的分子式(2)、写出化合物C的结构简式 , 化合物F的结构简式(3)、由D生成E的化学方程式为(4)、写出符合下列条件的B的同分异构体的结构简式①能发生银镜反应;
②核磁共振氢谱显示有2组峰
(5)、设计由苯和乙酰氯( )制备乙酰苯胺( )的合成路线(无机试剂任选)。
)的合成路线(无机试剂任选)。