陕西省安康市2020-2021学年高二下学期化学期末考试试卷
试卷更新日期:2021-07-02 类型:期末考试
一、选择题:本题共16小题,每小题3分,共48分。每小题给出的四个进项中,只有一个选项是符合题目要求的。
-
1. 化学与生产、生活、社会密切相关。下列说法错误的是( )A、制作面包类食品时,常用小苏打作膨松剂 B、高炉炼铁、生产水泥和制造玻璃都要用到石灰石 C、鉴别织物成分是蚕丝还是“人造丝”,可采用灼烧闻气味的方法 D、乙醇、过氧乙酸、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的2. 下列化学用语表示正确的是( )A、四氯化碳分子的比例模型:
 B、次氯酸的结构式:
C、羟基的电子式:
B、次氯酸的结构式:
C、羟基的电子式:  D、乙酸的电离方程式:
3. 下列说法正确的是( )A、乙烯与溴水发生取代反应生成1,2-二溴乙烷 B、糖类和蛋白质都是人体重要的营养物质 C、淀粉、油脂和蛋白质都属于高分子化合物 D、乙醇能与钠反应放出氢气,说明乙醇能电离产生 而表现酸性4. 下列过程没有颜色变化的是( )A、 与 溶液混合 B、加热充满 气体的玻璃球泡 C、酸性 溶液与 混合 D、苯酚与 溶液混合5. 下列有关有机物的实验可行的是( )A、用质谱仪鉴别1-丙醇和2-丙醇 B、利用乙烷和氯气的取代反应制取纯净的氯乙烷 C、用新制的氢氧化铜悬浊液来鉴别甲酸和甲醛 D、用酸性高锰酸钾溶液除去甲烷中的乙烯以得到纯净的甲烷6. 下列化合物中既易发生取代反成,也可发生加成反应,还能使酸性 溶液褪色的是( )A、甲苯 B、乙烷 C、乙醇 D、聚丙烯7. 设 为阿伏加德罗常数的数值。下列有关叙述正确的是( )A、12 g 晶体中阴离子所带电荷数为 B、78 g苯和苯乙烯的混合物中含有的碳氢键数为 C、 和 充分反应后,生成 的分子数为 D、 时, 的 溶液中含有 的个数为8. 某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产 晶体的工艺流程如图,下列说法错误的是( )
D、乙酸的电离方程式:
3. 下列说法正确的是( )A、乙烯与溴水发生取代反应生成1,2-二溴乙烷 B、糖类和蛋白质都是人体重要的营养物质 C、淀粉、油脂和蛋白质都属于高分子化合物 D、乙醇能与钠反应放出氢气,说明乙醇能电离产生 而表现酸性4. 下列过程没有颜色变化的是( )A、 与 溶液混合 B、加热充满 气体的玻璃球泡 C、酸性 溶液与 混合 D、苯酚与 溶液混合5. 下列有关有机物的实验可行的是( )A、用质谱仪鉴别1-丙醇和2-丙醇 B、利用乙烷和氯气的取代反应制取纯净的氯乙烷 C、用新制的氢氧化铜悬浊液来鉴别甲酸和甲醛 D、用酸性高锰酸钾溶液除去甲烷中的乙烯以得到纯净的甲烷6. 下列化合物中既易发生取代反成,也可发生加成反应,还能使酸性 溶液褪色的是( )A、甲苯 B、乙烷 C、乙醇 D、聚丙烯7. 设 为阿伏加德罗常数的数值。下列有关叙述正确的是( )A、12 g 晶体中阴离子所带电荷数为 B、78 g苯和苯乙烯的混合物中含有的碳氢键数为 C、 和 充分反应后,生成 的分子数为 D、 时, 的 溶液中含有 的个数为8. 某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产 晶体的工艺流程如图,下列说法错误的是( ) A、焙烧后的废气能使酸性高锰酸钾溶液褪色 B、氧化步骤中,用双氧水代替氯气会更好 C、调节pH选用的试剂可以是CuO固体 D、 晶体直接加热可制得 固体9. 下列实验操作能达到目的的是( )
A、焙烧后的废气能使酸性高锰酸钾溶液褪色 B、氧化步骤中,用双氧水代替氯气会更好 C、调节pH选用的试剂可以是CuO固体 D、 晶体直接加热可制得 固体9. 下列实验操作能达到目的的是( )选项
操作
目的
A
将混合气体通过饱和 溶液后干燥
除去 中的少量
B
测定相同浓度的 溶液、 溶液的pH
比较Cl和N的非金属性强弱
C
向AgCl浊液中滴加几滴 溶液
比较AgCl和AgI的 大小
D
向淀粉水解液中加入少量银氨溶液,水浴加热
证明淀粉水解液中含有葡萄糖
A、A B、B C、C D、D10. 如下为氟利昂(如 )破坏臭氧层的反应过程示意图,下列说法错误的是( ) A、氟利昂-12( )只有一种结构 B、过程Ⅱ可表示为 C、过程Ⅲ中 键断裂是放热过程, 键形成是吸热过程 D、上述过程说明氟利昂中氯原子是破坏 的催化剂11. 有机物
A、氟利昂-12( )只有一种结构 B、过程Ⅱ可表示为 C、过程Ⅲ中 键断裂是放热过程, 键形成是吸热过程 D、上述过程说明氟利昂中氯原子是破坏 的催化剂11. 有机物 的苯环上只有1个取代基,其结构有几种(不考虑立体异构)( ) A、4 B、5 C、6 D、712. 有机物M是合成某药品的中间体,结构简式为:
的苯环上只有1个取代基,其结构有几种(不考虑立体异构)( ) A、4 B、5 C、6 D、712. 有机物M是合成某药品的中间体,结构简式为: 。下列有关说法正确的是( ) A、M的分子式为 B、M易发生取代、加成、消去反应 C、用钠可检验M分子中是否存在羧基 D、M存在能发生很镜反应的同分异构体13. 在 时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )
。下列有关说法正确的是( ) A、M的分子式为 B、M易发生取代、加成、消去反应 C、用钠可检验M分子中是否存在羧基 D、M存在能发生很镜反应的同分异构体13. 在 时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )物质
X
Y
Z
起始浓度/( )
0.1
0.2
0
平衡浓度/( )
0.05
0.1
0.1
A、反应达到平衡时,Y的转化率为50% B、反应可表示为 ,平衡常数为200 C、其他条件不变时,增大压强可使平衡向右移动 D、若升温后Z的平衡浓度减小,则该反应为放热反应14. 二氯异丁酸钠是一种植物生长调节剂,可用于水稻增产,其化学式可表示为: ,其中Y元素的一种单质是植物光合作用的产物。下列说法错误的是( )A、简单离子半径大小: B、X分别与W、Y形成的最简单物质的沸点: C、最高价氧化物对应水化物的酸性: D、电解饱和MZ的水溶液,可得到M的单质15. 一种基于无机一有机杂化四钠盐分子(用P表示)的对称钠离子电池的结构如图所示,实线箭头和虚线箭头表示的是放电或充电过程中物质转化和离子移动的情况。下列说法正确的是( )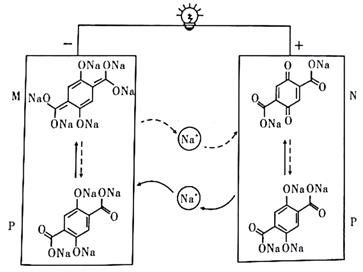 A、虚线箭头表示的是充电过程 B、电池工作一段时间后,需补充金属钠 C、放电时, 移向正极,与N结合生成P D、充电时,阴极反应式为16. 为二元酸,其电离过程 , 。常温时,向 水溶液中逐滴滴加 溶液,混合溶液中 、 和 的物质的量分数( )随pH变化的关系如图所示。下列叙述正确的是( )
A、虚线箭头表示的是充电过程 B、电池工作一段时间后,需补充金属钠 C、放电时, 移向正极,与N结合生成P D、充电时,阴极反应式为16. 为二元酸,其电离过程 , 。常温时,向 水溶液中逐滴滴加 溶液,混合溶液中 、 和 的物质的量分数( )随pH变化的关系如图所示。下列叙述正确的是( ) A、曲线Ⅱ代表的微粒是 B、常温下 的 C、混合液 时,溶液中 D、当溶液中 时,溶液的
A、曲线Ⅱ代表的微粒是 B、常温下 的 C、混合液 时,溶液中 D、当溶液中 时,溶液的二、非选择题:共52分。
-
17. 回答下列问题:(1)、
 (立方烷)与苯乙烯互为:。 (2)、
(立方烷)与苯乙烯互为:。 (2)、 的系统命名为:。 (3)、乙酸乙酯的核磁共振氢谱中,信号峰的面积之比为:。(4)、乙醇的沸点高于二甲醚( )的原因是:。(5)、对二甲苯分子中最多有个原子处于同一平面上。18. E是合成某药物的中间体,其一种合成路线如下:
的系统命名为:。 (3)、乙酸乙酯的核磁共振氢谱中,信号峰的面积之比为:。(4)、乙醇的沸点高于二甲醚( )的原因是:。(5)、对二甲苯分子中最多有个原子处于同一平面上。18. E是合成某药物的中间体,其一种合成路线如下: (1)、A的分子式为。(2)、 的化学方程式是。(3)、 的反应类型是。(4)、D的官能团的名称是。(5)、 的反应条件是。19. 过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下操作与装置(部分固定装置略)制备过氧化钙。
(1)、A的分子式为。(2)、 的化学方程式是。(3)、 的反应类型是。(4)、D的官能团的名称是。(5)、 的反应条件是。19. 过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下操作与装置(部分固定装置略)制备过氧化钙。
 (1)、三颈烧瓶中发生的主要反应的离子方程式为。(2)、用恒压分液漏斗盛装 和浓氨水相比用普通分液漏斗盛装的好处是。(3)、该反应常用冰水浴控制温度在0℃左右,其可能的原因是(写出一点即可)。(4)、测定产品中 含量的实验步骤如下:
(1)、三颈烧瓶中发生的主要反应的离子方程式为。(2)、用恒压分液漏斗盛装 和浓氨水相比用普通分液漏斗盛装的好处是。(3)、该反应常用冰水浴控制温度在0℃左右,其可能的原因是(写出一点即可)。(4)、测定产品中 含量的实验步骤如下:步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入少量 的硫酸,盖上瓶塞,充分反应;
步骤二:向上述锥形瓶中加入几滴淀粉溶液;
步骤三:用滴定管逐滴加入浓度为 的 溶液至反应完全。
记录数据,再重复上述操作2次,得出三次消耗 溶液的平均体积为V mL(已知: )。
①滴定至终点的现象是;
②产品中 的质量分数为%(用含a、c、V的代数式表示)。
20. 某小组以软锰矿(主要成分是 ,含少量 等杂质)为原料提取锰的流程如下(黄铁矿的主要成分是 ,部分产物和条件已省略):
已知:①酸浸中氧化产物为浅黄色固体,双氧水不能氧化 。
②常温下几种氢氧化物沉淀的pH如下:
金属氢氧化物
开始沉淀的pH
2.3
7.5
8.8
完全沉淀的pH
4.1
9.7
10.4
回答下列问题:
(1)、Si元素在周期表中的位置是。(2)、写出“酸浸”中主要反应的离子方程式:。(3)、滤渣1的主要成分是(填化学式)。(4)、调节pH时a的范围为。(5)、“电解”中产生的“废液”可以循环用于“酸浸”步骤,写出“电解”中发生反应的化学方程式。21. 乙酸是生活中常见的调味品。工业上,在一定条件下合成乙酸的原理为 。(1)、3种物质的燃烧热如表所示:物质
燃烧热
上述反应中 。
(2)、在恒温恒压条件下,进行上述反应,测得达到平衡时 ,在温度不条件下,将容器体积缩小至原来的 (不考虑液体的体积),则从缩小体积时到再次平衡时, 变化范围为。相对第一次平衡,达到第二次平衡时 将(填“增大”、“减小”或“不变”)。(3)、温度对上述反应的平衡常数K的影响如图A所示。

图A 图B
其中,能真实表示平衡常数K受温度影响的曲线是。
(4)、一定温度下,在恒容密封容器中充入 和 ,CO的平衡转化率与外界条件(温度、压强)的关系如图B所示。①L代表。
②M点对应的体系中, 。