2021年高考化学真题试卷(山东卷)
试卷更新日期:2021-07-02 类型:高考真卷
一、单选题
-
1. 有利于实现“碳达峰、碳中和”的是( )A、风能发电 B、粮食酿酒 C、燃煤脱硫 D、石油裂化2. 下列物质应用错误的是( )A、石墨用作润滑剂 B、氧化钙用作食品干燥剂 C、聚乙炔用作绝缘材料 D、乙二醇溶液用作汽车防冻液3. 关于下列仪器使用的说法错误的是( )
 A、①、④不可加热 B、②、④不可用作反应容器 C、③、⑤可用于物质分离 D、②、④、⑤使用前需检漏4. X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是( )A、原子半径:X>Y B、简单氢化物的还原性:X>Y C、同周期元素形成的单质中Y氧化性最强 D、同周期中第一电离能小于X的元素有4种5. 下列由实验现象所得结论错误的是( )A、向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 B、向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) C、向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 D、向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应6. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价7. 某同学进行蔗糖水解实验,并检验产物中的醛基,操作如下:向试管Ⅰ中加入1mL20%蔗糖溶液,加入3滴稀硫酸,水浴加热5分钟。打开盛有10%NaOH溶液的试剂瓶,将玻璃瓶塞倒放,取1mL溶液加入试管Ⅱ,盖紧瓶塞;向试管Ⅱ中加入5滴2%CuSO4溶液。将试管Ⅱ中反应液加入试管Ⅰ,用酒精灯加热试管Ⅰ并观察现象。实验中存在的错误有几处?( )A、1 B、2 C、3 D、48. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )
A、①、④不可加热 B、②、④不可用作反应容器 C、③、⑤可用于物质分离 D、②、④、⑤使用前需检漏4. X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是( )A、原子半径:X>Y B、简单氢化物的还原性:X>Y C、同周期元素形成的单质中Y氧化性最强 D、同周期中第一电离能小于X的元素有4种5. 下列由实验现象所得结论错误的是( )A、向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 B、向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) C、向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 D、向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应6. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价7. 某同学进行蔗糖水解实验,并检验产物中的醛基,操作如下:向试管Ⅰ中加入1mL20%蔗糖溶液,加入3滴稀硫酸,水浴加热5分钟。打开盛有10%NaOH溶液的试剂瓶,将玻璃瓶塞倒放,取1mL溶液加入试管Ⅱ,盖紧瓶塞;向试管Ⅱ中加入5滴2%CuSO4溶液。将试管Ⅱ中反应液加入试管Ⅰ,用酒精灯加热试管Ⅰ并观察现象。实验中存在的错误有几处?( )A、1 B、2 C、3 D、48. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( ) A、吸收过程中有气体生成 B、结晶后母液中含有NaHCO3 C、气流干燥湿料时温度不宜过高 D、中和后溶液中含Na2SO3和NaHCO39. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同10. 以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )A、放电过程中,K+均向负极移动 B、放电过程中,KOH物质的量均减小 C、消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大 D、消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L
A、吸收过程中有气体生成 B、结晶后母液中含有NaHCO3 C、气流干燥湿料时温度不宜过高 D、中和后溶液中含Na2SO3和NaHCO39. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同10. 以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )A、放电过程中,K+均向负极移动 B、放电过程中,KOH物质的量均减小 C、消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大 D、消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L二、不定项选择题
-
11. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)( )
实验目的
玻璃仪器
试剂
A
配制100mL一定物质的量浓度的NaCl溶液
100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒
蒸馏水、NaCl固体
B
制备Fe(OH)3胶体
烧杯、酒精灯、胶头滴管
蒸馏水、饱和FeCl3溶液
C
测定NaOH溶液浓度
烧杯、锥形瓶、胶头滴管、酸式滴定管
待测NaOH溶液、已知浓度的盐酸、甲基橙试剂
D
制备乙酸乙酯
试管、量筒、导管、酒精灯
冰醋酸、无水乙醇、饱和Na2CO3溶液
A、A B、B C、C D、D12. 立体异构包括顺反异构、对映异构等。有机物M(2-甲基-2-丁醇)存在如图转化关系,下列说法错误的是( ) A、N分子可能存在顺反异构 B、L的任一同分异构体最多有1个手性碳原子 C、M的同分异构体中,能被氧化为酮的醇有4种 D、L的同分异构体中,含两种化学环境氢的只有1种13. 实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
A、N分子可能存在顺反异构 B、L的任一同分异构体最多有1个手性碳原子 C、M的同分异构体中,能被氧化为酮的醇有4种 D、L的同分异构体中,含两种化学环境氢的只有1种13. 实验室中利用固体KMnO4进行如图实验,下列说法错误的是( ) A、G与H均为氧化产物 B、实验中KMnO4只作氧化剂 C、Mn元素至少参与了3个氧化还原反应 D、G与H的物质的量之和可能为0.25mol14. 18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:
A、G与H均为氧化产物 B、实验中KMnO4只作氧化剂 C、Mn元素至少参与了3个氧化还原反应 D、G与H的物质的量之和可能为0.25mol14. 18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为: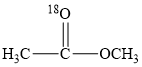 +OH-
+OH- 
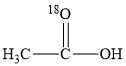 +CH3O-能量变化如图所示。已知
+CH3O-能量变化如图所示。已知 
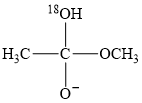 为快速平衡,下列说法正确的是( )
为快速平衡,下列说法正确的是( )  A、反应Ⅱ、Ⅲ为决速步 B、反应结束后,溶液中存在18OH- C、反应结束后,溶液中存在CH318OH D、反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变15. 赖氨酸[H3N+(CH2)4CH(NH2)COO- , 用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+ HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述正确的是( )
A、反应Ⅱ、Ⅲ为决速步 B、反应结束后,溶液中存在18OH- C、反应结束后,溶液中存在CH318OH D、反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变15. 赖氨酸[H3N+(CH2)4CH(NH2)COO- , 用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+ HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述正确的是( ) A、 > B、M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) C、O点,pH= D、P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
A、 > B、M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) C、O点,pH= D、P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)三、解答题
-
16. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子核外电子的运动状态有 种。(2)、O、F、Cl电负性由大到小的顺序为;OF2分子的空间构型为;OF2的熔、沸点 (填“高于”或“低于”)Cl2O,原因是。(3)、Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为 , 下列对XeF2中心原子杂化方式推断合理的是(填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(4)、XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( , , )。已知Xe—F键长为rpm,则B点原子的分数坐标为;晶胞中A、B间距离d=pm。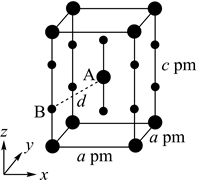 17. 工业上以铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题:
17. 工业上以铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题: (1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
(1)、焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是。(2)、矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。
(3)、蒸发结晶时,过度蒸发将导致;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有。(4)、利用膜电解技术(装置如图所示),以Na2Cr2O4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2Cr2O4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在(填“阴”或“阳”)极室制得,电解时通过膜的离子主要为。 18. 六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2 , 极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6 , 装置如图所示(夹持装置略)。回答下列问题:
18. 六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2 , 极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6 , 装置如图所示(夹持装置略)。回答下列问题: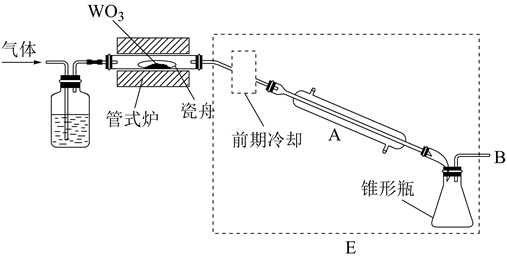 (1)、检查装置气密性并加入WO3。先通N2 , 其目的是;一段时间后,加热管式炉,改通H2 , 对B处逸出的H2进行后续处理。仪器A的名称为 , 证明WO3已被完全还原的现象是。(2)、WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是;操作④是 , 目的是。(3)、利用碘量法测定WCl6产品纯度,实验如下:
(1)、检查装置气密性并加入WO3。先通N2 , 其目的是;一段时间后,加热管式炉,改通H2 , 对B处逸出的H2进行后续处理。仪器A的名称为 , 证明WO3已被完全还原的现象是。(2)、WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是;操作④是 , 目的是。(3)、利用碘量法测定WCl6产品纯度,实验如下:①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO +Ba(IO3)2=BaWO4+2IO ;交换结束后,向所得含IO 的溶液中加入适量酸化的KI溶液,发生反应:IO +5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O 。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。
19. 一种利胆药物F的合成路线如图: 已知:Ⅰ.
已知:Ⅰ. 
 +
+ 
Ⅱ.

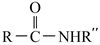
回答下列问题:
(1)、A的结构简式为;符合下列条件的A的同分异构体有种。①含有酚羟基 ②不能发生银镜反应 ③含有四种化学环境的氢
(2)、检验B中是否含有A的试剂为;B→C的反应类型为。(3)、C→D的化学方程式为;E中含氧官能团共种。(4)、已知: ,综合上述信息,写出由
,综合上述信息,写出由  和
和  制备
制备  的合成路线。 20. 2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
的合成路线。 20. 2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:反应Ⅰ:
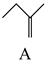 +CH3OH
+CH3OH 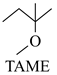 △H1
△H1反应Ⅱ:
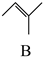 +CH3OH
+CH3OH 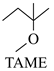 △H2
△H2反应Ⅲ:

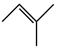 △H3
△H3回答下列问题:
(1)、反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是 (用系统命名法命名); 的数值范围是(填标号)。A.<-1 B.-1~0 C.0~1 D.>1
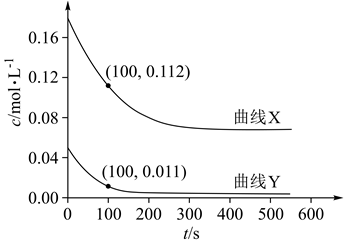
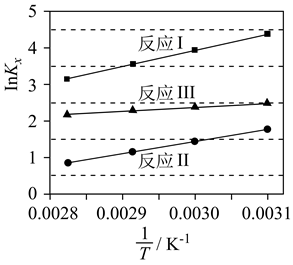 (2)、为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为mol,反应Ⅰ的平衡常数Kx1=。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将 (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=。(3)、为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正逆反应速率v逆(填“>”“<”或“=)。
(2)、为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为mol,反应Ⅰ的平衡常数Kx1=。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将 (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=。(3)、为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正逆反应速率v逆(填“>”“<”或“=)。