河南省2021年中考化学试卷
试卷更新日期:2021-07-02 类型:中考真卷
一、单选题
-
1. 河南博物院馆藏丰富,下列相关制作过程中一定发生了化学变化的是( )A、玉器雕琢 B、骨笛打孔 C、彩陶烧制 D、金筒刻字2. 日常生活中,用得最多的材料是有机合成材料。下列不属于有机合成材料的是( )A、合金 B、塑料 C、合成橡胶 D、合成纤维3. 侯德榜是我国制碱工业的先驱。侯氏制碱法中的“碱”是指纯碱,其化学式为( )A、Na2CO3 B、NaHCO3 C、NaOH D、NaCl4. “84消毒液”的有效成分次氯酸钠(NaClO)中,氯元素的化合价为( )A、-1 B、+1 C、+5 D、+75. 下列物质在氧气里燃烧时,能生成有刺激性气味的气体的是( )A、铁丝 B、硫 C、镁条 D、木炭6. 古籍记载“曾青得铁则化为钢”,指可溶性的铜的化合物与铁反应得到铜,该反应为( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应7. 规范的操作方法是实验安全和成功的保证,下列图示的实验操作正确的是( )A、点燃酒精灯
 B、加热液体
B、加热液体  C、收集氢气
C、收集氢气  D、稀释浓硫酸
D、稀释浓硫酸  8. 2021年世界水日的主题是“珍惜水、爱护水”。下列说法正确的是( )A、地球上的淡水资源十分丰富 B、部分结冰的蒸馏水属于混合物 C、水是由氢分子和氧原子构成的 D、硬水中含有较多可溶性钙、镁化合物9. 黑火药爆炸事件的反应为: ,则X是( )A、K2S B、K2SO3 C、K2SO4 D、K2S2O310. 如图是KNO3和NaCl的溶解度曲线,下列说法正确的是( )
8. 2021年世界水日的主题是“珍惜水、爱护水”。下列说法正确的是( )A、地球上的淡水资源十分丰富 B、部分结冰的蒸馏水属于混合物 C、水是由氢分子和氧原子构成的 D、硬水中含有较多可溶性钙、镁化合物9. 黑火药爆炸事件的反应为: ,则X是( )A、K2S B、K2SO3 C、K2SO4 D、K2S2O310. 如图是KNO3和NaCl的溶解度曲线,下列说法正确的是( )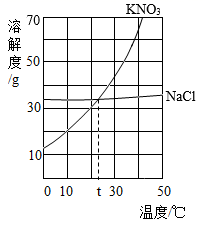 A、KNO3的溶解度大于NaCl的溶解度 B、t℃时,两种物质的饱和溶液中溶质的质量分数相等 C、30℃时,30gNaCl加入到100g水中可得到饱和溶液 D、将40℃时一定质量的KNO3的饱和溶液降温到20℃,该溶液中溶质的质量保持不变11. 现有下列反应:① ② ③ 。其中适用于实验室制取氧气的是( )A、①② B、②③ C、①③ D、①②③12. 下列根据某些性质区分一些常见物质的方法错误的是( )A、羊毛和涤纶:灼烧闻气味 B、硫酸铵和氯化铵:加熟石灰研磨 C、铜片和黄铜片:相互刻画 D、氧气和二氧化碳:伸入燃着的木条13. 下列四个图像分别与选项中的操作相对应,其中可能合理的是( )A、
A、KNO3的溶解度大于NaCl的溶解度 B、t℃时,两种物质的饱和溶液中溶质的质量分数相等 C、30℃时,30gNaCl加入到100g水中可得到饱和溶液 D、将40℃时一定质量的KNO3的饱和溶液降温到20℃,该溶液中溶质的质量保持不变11. 现有下列反应:① ② ③ 。其中适用于实验室制取氧气的是( )A、①② B、②③ C、①③ D、①②③12. 下列根据某些性质区分一些常见物质的方法错误的是( )A、羊毛和涤纶:灼烧闻气味 B、硫酸铵和氯化铵:加熟石灰研磨 C、铜片和黄铜片:相互刻画 D、氧气和二氧化碳:伸入燃着的木条13. 下列四个图像分别与选项中的操作相对应,其中可能合理的是( )A、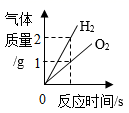 电解一定质量的水
B、
电解一定质量的水
B、 向一定质量的氢氧化钠溶液中滴加水
C、
向一定质量的氢氧化钠溶液中滴加水
C、 向一定质量的饱和氢氧化钙溶液中加入氧化钙
D、
向一定质量的饱和氢氧化钙溶液中加入氧化钙
D、 向一定质量的盐酸和氯化钙混合溶液中滴加碳酸钠溶液
14. 现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )A、NaCl B、CaCl2 C、AlCl3 D、KCl
向一定质量的盐酸和氯化钙混合溶液中滴加碳酸钠溶液
14. 现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )A、NaCl B、CaCl2 C、AlCl3 D、KCl二、填空题
-
15. 空气中含量多且常用作保护气的是 , 人体中含量最高的元素是。16. 大米、面粉中含有的糖类物质主要是淀粉,淀粉的化学式为(填“C2H5OH”、“C6H12O6”或“(C6H10O5)n”);施用化肥是农业增产的重要手段,尿素(CO(NH2)2)属于(填“氮肥”“磷肥”或“钾肥”)。17. 氢氧化钠溶液与盐酸反应的化学方程式为 , 如图是该反应的微观示意图,则该反应前后没有发生变化的离子有 , 从微观角度看,该化学反应的实质是。
 18. 实验室除去粗实验中难溶性杂质的主要实验步骤有:溶解、、蒸发;除去粗实验水中的杂质CaCl2、MgCl2、Na2SO4 , 可依次加入过量的NaOH、、Na2CO3溶液,分离出沉淀后,再加入适量盐酸,其作用是。19. 开发利用清洁高效的新能源,减少CO2的排放,有利于实现“碳中和”。(1)、氢气是一种理想的新能源,氢气燃烧的化学方程式为 , 实验室用锌与稀硫酸反应制取氢气的化学方程式为。(2)、某有机物与N2O4反应释放能量,可做高能能源。该有机物18g与一定质量的N2O4恰好完全反应,可生成26.4gCO2、21.6gH2O和25.2gN2 , 实验测得其相对分子质量为60,该有机物的化学式为。
18. 实验室除去粗实验中难溶性杂质的主要实验步骤有:溶解、、蒸发;除去粗实验水中的杂质CaCl2、MgCl2、Na2SO4 , 可依次加入过量的NaOH、、Na2CO3溶液,分离出沉淀后,再加入适量盐酸,其作用是。19. 开发利用清洁高效的新能源,减少CO2的排放,有利于实现“碳中和”。(1)、氢气是一种理想的新能源,氢气燃烧的化学方程式为 , 实验室用锌与稀硫酸反应制取氢气的化学方程式为。(2)、某有机物与N2O4反应释放能量,可做高能能源。该有机物18g与一定质量的N2O4恰好完全反应,可生成26.4gCO2、21.6gH2O和25.2gN2 , 实验测得其相对分子质量为60,该有机物的化学式为。三、综合题
-
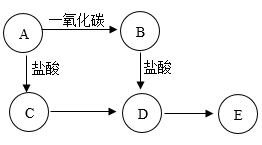
20. A、B、C、D、E均含有同一种金属元素,它们之间的转化关系如右图所示(“→”表示反应可一步实现,部分物质和反应条件略去)。已知A为氧化物,其中金属元素显+3价,且其质量分数为70%;B为单质,E为难溶性碱;A→B是工业制取B的主要原理, A的化学式为;D→E的化学方程式为;C与B可发生化合反应生成D,该反应的化学方程式为。
 21. 请从分子的角度解释下列生产、生活中的现象。(1)、湿衣服在太阳下晾晒比在阴凉处干的更快。(2)、加压时,3000L的氧气可装入溶剂为20L的钢瓶中。22. 某化学小组用如图所示的实验装置进行探究实验。
21. 请从分子的角度解释下列生产、生活中的现象。(1)、湿衣服在太阳下晾晒比在阴凉处干的更快。(2)、加压时,3000L的氧气可装入溶剂为20L的钢瓶中。22. 某化学小组用如图所示的实验装置进行探究实验。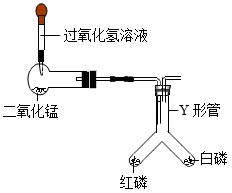 (1)、请写出滴加过氧化氢溶液时发生反应的化学方程式。(2)、用80℃的水加热Y形管,白磷燃烧而红磷不燃烧,说明燃烧需要什么条件?23. 实验室选用下列仪器配置50g质量分数为6%的氯化钠溶液。
(1)、请写出滴加过氧化氢溶液时发生反应的化学方程式。(2)、用80℃的水加热Y形管,白磷燃烧而红磷不燃烧,说明燃烧需要什么条件?23. 实验室选用下列仪器配置50g质量分数为6%的氯化钠溶液。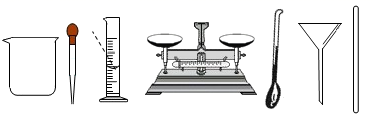 (1)、所需氯化钠固体的质量为g。(2)、完成该实验,上图中有一种仪器不必用到,请写出该仪器的名称。(3)、若其他操作正确,量取水时俯视读数,对结果会造成什么影响?24. 从废旧手机的某些部件中可回收银和铜,其操作流程如图所示。
(1)、所需氯化钠固体的质量为g。(2)、完成该实验,上图中有一种仪器不必用到,请写出该仪器的名称。(3)、若其他操作正确,量取水时俯视读数,对结果会造成什么影响?24. 从废旧手机的某些部件中可回收银和铜,其操作流程如图所示。 (1)、请写出步骤Ⅰ中发生反应的化学方程式。(写一个即可)(2)、步骤Ⅱ中,加入硝酸银溶液的作用是什么?(3)、步骤Ⅲ中,若溶液乙的质量大于溶液甲,确定M后写出发生反应的化学方程式。25. 碳及其化合物与生产、生活密切相关,是化学学习和研究的重要内容。
(1)、请写出步骤Ⅰ中发生反应的化学方程式。(写一个即可)(2)、步骤Ⅱ中,加入硝酸银溶液的作用是什么?(3)、步骤Ⅲ中,若溶液乙的质量大于溶液甲,确定M后写出发生反应的化学方程式。25. 碳及其化合物与生产、生活密切相关,是化学学习和研究的重要内容。 (1)、请将如图虚线框内碳原子的结构示意图补画完整。(2)、金刚石和石墨都属于碳单质,它们的化学性质相似,物理性质却有很大差异,其原因是(填字母代号)。
(1)、请将如图虚线框内碳原子的结构示意图补画完整。(2)、金刚石和石墨都属于碳单质,它们的化学性质相似,物理性质却有很大差异,其原因是(填字母代号)。a构成它们原子的大小不同 b两种物质有不同种原子构成
c构成它们的原子数目不同 d两种物质里碳原子的排列方式不同
(3)、某同学用如图装置(铁架台等略去)制取纯碱干燥的CO2 , 并探究CO2的性质。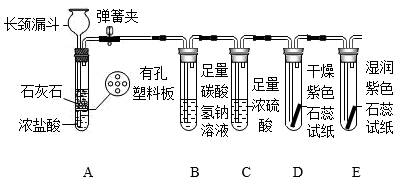
①A装置能控制反应的发生和停止,请简述使反应停止的原理。
②B装置中可能发生反应的化学方程式为。
③证明CO2与水发生了化学反应的实验现象为。
(4)、制取CO2后的酸性废液需处理后再排放;除去CO2常用碱液吸收法。①检验某废液是否呈酸性,可选用的一种试剂(或用品)是。
②为探究足量NaOH溶液吸收CO2后溶液中溶质成分,某同学设计了如下方案:取少量溶液,加入足量Ca(OH)2溶液,反应后静置,取上层清液滴加酚酞溶液。若溶液变红,溶质为Na2CO3和NaOH。请指出该方案中的不正确并加以改正。
(5)、某温室大棚需用到440LCO2(按标准状况计算,CO2密度为1.964gL),用足量盐酸与含CaCO380%的石灰石反应制取,需要这种石灰石的质量是多少?