福建省2021年中考化学试卷
试卷更新日期:2021-07-02 类型:中考真卷
一、单选题
-
1. 运动型功能饮料含有下列营养素,其中主要用于补充能量的是( )A、葡萄糖 B、维生素 C、水 D、无机盐2. 全硼富勒烯团簇( )的分子结构像中国红灯笼(如图)。 属于( )

 A、单质 B、氧化物 C、酸 D、盐3. “庄稼一枝花,全靠肥当家。”下列属于复合肥料的是( )A、NH4HCO3 B、KCl C、(NH4)2HPO4 D、CO(NH2)24. 大蒜素(C6H10S2O)能抑制和杀灭多种细菌。下列有关大蒜素的说法,错误的是( )A、氢元素的质量分数最大 B、由4种元素组成 C、一个分子由19个原子构成 D、属于有机化合物5. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、
A、单质 B、氧化物 C、酸 D、盐3. “庄稼一枝花,全靠肥当家。”下列属于复合肥料的是( )A、NH4HCO3 B、KCl C、(NH4)2HPO4 D、CO(NH2)24. 大蒜素(C6H10S2O)能抑制和杀灭多种细菌。下列有关大蒜素的说法,错误的是( )A、氢元素的质量分数最大 B、由4种元素组成 C、一个分子由19个原子构成 D、属于有机化合物5. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、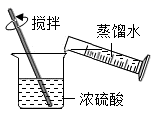 稀释浓硫酸
B、
稀释浓硫酸
B、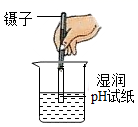 测稀硫酸的pH
C、
测稀硫酸的pH
C、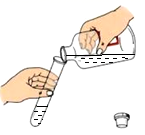 倾倒稀硫酸
D、
倾倒稀硫酸
D、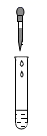 滴加稀硫酸
6. 据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是( )A、能与盐酸反应产生氢气 B、在空气中容易锈蚀 C、能与硫酸亚铁发生置换反应 D、具有良好的导电性7. 抗击新冠肺炎疫情离不开化学知识和技术。下列说法错误的是( )A、高温消毒餐具,使病毒在高温下失去活性 B、使用医用酒精消毒要远离火源,因为酒精有可燃性 C、将酒精加工成免洗消毒凝胶,使酒精分子停止运动而不挥发 D、测定新冠病毒的组成和结构,有助于研发治疗新冠肺炎的药物8. 下列实验方案不能达到目的的是( )
滴加稀硫酸
6. 据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是( )A、能与盐酸反应产生氢气 B、在空气中容易锈蚀 C、能与硫酸亚铁发生置换反应 D、具有良好的导电性7. 抗击新冠肺炎疫情离不开化学知识和技术。下列说法错误的是( )A、高温消毒餐具,使病毒在高温下失去活性 B、使用医用酒精消毒要远离火源,因为酒精有可燃性 C、将酒精加工成免洗消毒凝胶,使酒精分子停止运动而不挥发 D、测定新冠病毒的组成和结构,有助于研发治疗新冠肺炎的药物8. 下列实验方案不能达到目的的是( )实验目的
实验方案
A
除去水中的异味和色素
用活性炭吸附
B
鉴别硬水和软水
取样,分别加入肥皂水,振荡
C
除去FeCl2溶液中的CuCl2杂质
加入过量的铁屑充分反应,过滤
D
检验久置的NaOH是否变质
取样,滴加酚酞溶液
A、A B、B C、C D、D9. 某兴趣小组为探究影响化学反应速率的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间的变化曲线如图所示。选取CO2的浓度从0~8%为研究对象,下列实验结果的分析,错误的是( ) A、对比①③,温度越高,反应速率越快 B、对比②③,反应物接触面积越小,反应速率越慢 C、对比③④,反应物接触面积越大,反应速率越快 D、对比①②③④,④的反应速率最慢10. 甲、乙、丙三种物质有如下转化关系: 。在不断搅拌下,往装有甲溶液的容器中逐滴加入稀盐酸依次发生①、②反应,同时测定容器中液体的透光强度(液体越浑浊,透光强度越小),结果如图。下列分析错误的是( )
A、对比①③,温度越高,反应速率越快 B、对比②③,反应物接触面积越小,反应速率越慢 C、对比③④,反应物接触面积越大,反应速率越快 D、对比①②③④,④的反应速率最慢10. 甲、乙、丙三种物质有如下转化关系: 。在不断搅拌下,往装有甲溶液的容器中逐滴加入稀盐酸依次发生①、②反应,同时测定容器中液体的透光强度(液体越浑浊,透光强度越小),结果如图。下列分析错误的是( ) A、乙难溶于水 B、甲可能是NaOH C、QM段对应反应② D、E,F对应的液体组成不同
A、乙难溶于水 B、甲可能是NaOH C、QM段对应反应② D、E,F对应的液体组成不同二、填空题
-
11. “嫦娥五号”月球采样返回,“天问一号”成功抵达火星,标志着我国航天事业取得突破性进展。(1)、月壤含CaAl2Si2O8以及可作为核聚变燃料的氦-3等物质。
①CaAl2Si2O8中,Si、O两种元素的质量比为。
②如图为氦在元素周期表中的部分信息。氦-3原子的质子数与中子数之和为3则其中子数为、核外电子数为。
 (2)、着陆器上的仪器可探测水。若月球上存在大量的水,可利用光催化分解水技术得到氧气,对人类在月球上活动意义重大,该反应的化学方程式为。(3)、火星拥有丰富的金属矿物和二氧化碳等资源。火星低层大气的主要成分如下表。
(2)、着陆器上的仪器可探测水。若月球上存在大量的水,可利用光催化分解水技术得到氧气,对人类在月球上活动意义重大,该反应的化学方程式为。(3)、火星拥有丰富的金属矿物和二氧化碳等资源。火星低层大气的主要成分如下表。气体成分
CO2
N2
Ar
O2
其他
体积分数/%
95.32
2.7
1.6
0.13
0.25
①为鉴别一瓶模拟“火星低层大气”组成的气体和一瓶空气,可采用的化学方法是。
②若为满足人类未来在火星上生活,下列研究设想不合理的是(填标号)。
a.将CO2转化为O2 , 提高O2含量
b.将CO2分解转化为N2 , 提高N2含量
c.寻找水的存在和开发水循环技术
d.利用火星上的金属矿物冶炼金属
12. 钢铁是应用广泛的金属材料。(1)、英国学者R·坦普尔论证了我国古代冶铁技术世界第一。早在公元前4世纪,中国已广泛利用铁矿石与木炭生产生铁,并加入“黑土”以降低生铁的熔化温度;公元前2世纪,中国人发明了“充氧”等炼钢法。①“黑土”含有磷酸铁(FePO4),其中磷元素的化合价为。
②生铁生产过程中,一氧化碳与氧化铁在高温下反应的化学方程式为。
③炼钢中“充氧”的目的是降低生铁中的 , 获得性能更好的钢。
(2)、对钢铁制品进行“发蓝”处理,使其表面生成一层致密的氧化膜,能有效防止钢铁锈蚀。①“发蓝”过程发生了(填“物理变化”或“化学变化”)。
②致密氧化膜能防止钢铁锈蚀的原因是。
13. 如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,俟晒结浮白,扫而复淋”。 (1)、“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为。(2)、经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。
(1)、“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为。(2)、经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。①1000g“上等卤水”蒸干后,可得氯化钠的质量约为g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是。
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水100g、NaCl 39.8g、MgCl27.65g及其他成分2.55g。将150g此溶液降温至20℃,有g NaCl析出(溶解度见表)。此时,(填“有”或“没有”)MgCl2析出,原因是。
温度/℃
20
60
100
溶解度/g
NaCl
36.0
37.3
39.8
MgCl2
54.8
61.3
73.0
14. 为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜(Cu2(OH)2CO3)可改写为Cu(OH)2·CuCO3 , 推测其兼具Cu(OH)2和CuCO3的化学性质。(1)、举重运动员常用碱式碳酸镁(Mg2(OH)2CO3)粉末抹在手掌以增大摩擦力。①参照上述方法,碱式碳酸镁的化学式可改写为。
②该物质兼具(填“酸”或“碱”)和碳酸盐的化学性质。
③该物质分解的化学方程式为 ,X的化学式为。
(2)、某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3·3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式为。三、综合题
-
15. 为解决能源与环境问题,有学者提出如右图所示的含碳物质转化的技术路线。
 (1)、“可燃冰”中甲烷完全燃烧的化学方程式为。(2)、反应②属于(填基本反应类型)。(3)、反应④中,参加反应的CO2和生成的CH4的分子数目之比为。(4)、我国学者开发出促进反应③的一种新型催化剂,催化过程微观示意图如图。该过程的中间产物(填化学式)、氧和氢进一步作用生成甲醇(CH3OH)和水。
(1)、“可燃冰”中甲烷完全燃烧的化学方程式为。(2)、反应②属于(填基本反应类型)。(3)、反应④中,参加反应的CO2和生成的CH4的分子数目之比为。(4)、我国学者开发出促进反应③的一种新型催化剂,催化过程微观示意图如图。该过程的中间产物(填化学式)、氧和氢进一步作用生成甲醇(CH3OH)和水。 (5)、该技术路线有利于实现(填标号)。
(5)、该技术路线有利于实现(填标号)。a.碳循环利用 b.减少碳排放 c.减少白色污染
16. 下列装置常用于实验室制取气体。 (1)、仪器①的名称是。(2)、用装置甲制取氧气,采用该收集方法的依据是。用收集的氧气做铁丝燃烧实验,应预先在集气瓶中加入少量的。(3)、用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是。(4)、在加热条件下,用醋酸钠( CH3COONa)固体与碱石灰固体中的氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是(填“甲”或“乙”),反应的化学方程式为。17. 已知: 。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对此开展如下探究。(1)、I.设计如实验装置,开展氢气还原氧化铜实验并检验固体产物。
(1)、仪器①的名称是。(2)、用装置甲制取氧气,采用该收集方法的依据是。用收集的氧气做铁丝燃烧实验,应预先在集气瓶中加入少量的。(3)、用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是。(4)、在加热条件下,用醋酸钠( CH3COONa)固体与碱石灰固体中的氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是(填“甲”或“乙”),反应的化学方程式为。17. 已知: 。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对此开展如下探究。(1)、I.设计如实验装置,开展氢气还原氧化铜实验并检验固体产物。
制取氢气的化学方程式为。
(2)、氧化钙的作用是。(3)、取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到 , 证明固体产物有Cu2O。(4)、II.探究反应生成Cu2O的变化情况。称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图。

由图可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是。
(5)、为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是。(6)、III.探究反应生成Cu2O的原因。为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1.经历 、 两个反应,且在同一条件下两个反应同时进行。
假设2.经历 、 、 三个反应。
结合探究II结果计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是。
(7)、若要确认“假设2”是否合理,在探究II的基础上,还需进行的实验是。四、计算题
-
18. “7150灭火剂”(C3H9B3O6 , 相对分子质量为174)以雾状形式喷射到燃着的金属时,立即发生燃烧反应: 。反应能很快耗尽金属物品附近的氧气,生成的玻璃状B2O3覆盖在金属物品表面而隔绝空气,从而有效灭火。若充分燃烧348g“7150灭火剂”,会消耗常温下的氧气多少升?(常温下氧气密度约为1.4g·L-1 , 结果保留一位小数)。