重庆市2021年中考化学试卷(A卷)
试卷更新日期:2021-07-02 类型:中考真卷
一、单选题
-
1. 2021年世界环境日中国主题是“人与自然和谐共生”。下列做法不符合这一理念的是( )A、坚持绿色出行 B、野外焚烧垃圾 C、教科书循环使用 D、废旧电池回收处理2. 铁是目前人类使用最广泛的金属。下列过程中没有发生化学变化的是( )A、铁丝织网 B、矿石炼铁 C、钢铁生锈 D、湿法炼铜3. 分类是学习化学的一种方法,下列物质属于纯净物的是( )A、糖水 B、空气 C、黄铜 D、干冰4. 2021年印度新冠疫情加剧,导致其国内氧气供应严重不足。下列关于氧气的说法错误的是( )A、用于医疗急救 B、易溶于水 C、能使带火星木条复燃 D、可贮存在钢瓶中5. 叶子发黄的水稻易倒伏,专家建议施用含钾的复合肥料。下列肥料符合要求的是( )A、NH4NO3 B、KNO3 C、NH4H2PO4 D、K2SO46. 实验室里,可用火法制备锰的化学方程式为 ,其中表现出还原性的物质是( )A、Al B、MnO2 C、Al2O3 D、Mn7. 2021年3月22日是“世界水日”,自来水净水过程中不涉及的环节是( )A、沉淀 B、蒸馏 C、吸附 D、消毒8. 生产生活中常用氮气作保护气,主要是因为氮气( )A、无色无味 B、密度与空气接近 C、熔沸点低 D、化学性质不活泼9. 从中草药中提取的 calebin A(化学式为C21H20O7)可用于治疗阿尔茨海默症。下列关于calebin A的说法错误的是( )A、属于有机物 B、由碳、氢、氧三种元素组成 C、一个分子由48个原子构成 D、其中氧元素的质量分数最小10. “火锅”当选为“重庆十大文化符号”之首。下列做法合理的是( )A、清洗用过的筷子并高温消毒 B、用甲醛溶液处理毛肚 C、在门窗紧闭的家里吃炭火火锅 D、吃清洗过的霉变苕粉11. 实验室制取二氧化碳部分操作如图所示,其中错误的是( )A、
 检查装置的气密性
B、
检查装置的气密性
B、 仪器连接
C、
仪器连接
C、 加入药品
D、
加入药品
D、 收集气体
12. 2020年科学家开发出新型催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如图,下列关于该反应的说法正确的是( )
收集气体
12. 2020年科学家开发出新型催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如图,下列关于该反应的说法正确的是( )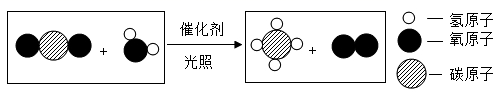 A、属于置换反应 B、反应前后原子种类改变 C、反应中涉及2种氧化物 D、参加反应的反应物分子个数比为1:113. 我国“天问一号”探测器成功着陆火星,发现火星表面被赤铁矿覆盖,平均温度约为-56℃,火星大气中含有CO2(体积分数为95.3%)、O2、H2O等物质,下列说法正确的是( )A、火星上白磷无法自燃 B、火星上缺少金属资源 C、火星大气组成与空气相似 D、火星地表不存在固态水14. 石油古称“水”,《汉书》中“高奴县洧水可燃”、《梦溪笔谈》中“予知其烟可用,试扫其烟为墨,黑光如漆”,下列关于“洧水”的说法错误的是( )A、具有可燃性 B、是一种黏稠状液体 C、是可再生能源 D、“其烟”的主要成分为炭黑15. 下列实验目的通过对应实验操作能达到的是( )
A、属于置换反应 B、反应前后原子种类改变 C、反应中涉及2种氧化物 D、参加反应的反应物分子个数比为1:113. 我国“天问一号”探测器成功着陆火星,发现火星表面被赤铁矿覆盖,平均温度约为-56℃,火星大气中含有CO2(体积分数为95.3%)、O2、H2O等物质,下列说法正确的是( )A、火星上白磷无法自燃 B、火星上缺少金属资源 C、火星大气组成与空气相似 D、火星地表不存在固态水14. 石油古称“水”,《汉书》中“高奴县洧水可燃”、《梦溪笔谈》中“予知其烟可用,试扫其烟为墨,黑光如漆”,下列关于“洧水”的说法错误的是( )A、具有可燃性 B、是一种黏稠状液体 C、是可再生能源 D、“其烟”的主要成分为炭黑15. 下列实验目的通过对应实验操作能达到的是( )序号
实验目的
实验操作
A
除去CO中的H2
通过灼热的CuO
B
鉴别MnO2粉末和木炭粉
分别加水搅拌
C
除去KNO3溶液中的KCl
加入过量的AgNO3
D
鉴别化肥NH4Cl和KNO3
分别加入熟石灰研磨后闻气味
A、A B、B C、C D、D16. 向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH)2溶液,烧杯中溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列有关说法正确的是( )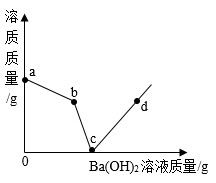 A、a→b段溶液的质量一定减小 B、b→c段有水生成 C、b点溶液溶质为硫酸铜 D、d点沉淀质量与b点沉淀质量相等
A、a→b段溶液的质量一定减小 B、b→c段有水生成 C、b点溶液溶质为硫酸铜 D、d点沉淀质量与b点沉淀质量相等二、填空题
-
17. 糖尿病检验原理之一是将含有葡萄糖(C6H12O6)的尿液与新制Cu(OH)2共热,产生砖红色沉淀,该沉淀为氧化亚铜,请用化学用语填空。(1)、2个铜原子 , 3个氢氧根离子。(2)、铜元素常显0、+1、+2价,氧化亚铜的化学式为。(3)、葡萄糖在人体内缓慢氧化生成CO2和 , 并释放能量。18. 人体中质量分数在0.01%以下的元素称为微量元素。如图表示部分元素在人体中的质量分数及有关元素信息。
 (1)、图1中钙元素为(填“常量”或“微量”)元素(2)、图2为某粒子的结构示意图,其最外层电子数为。(3)、以铁元素为主要成分的生铁比纯铁硬度 (填“大”或“小”)。(4)、钾在空气中加热发生化合反应生成超氧化钾(KO2)的化学方程式为。19. NaOH、KNO3和Na2CO3在不同温度下的溶解度如表所示。
(1)、图1中钙元素为(填“常量”或“微量”)元素(2)、图2为某粒子的结构示意图,其最外层电子数为。(3)、以铁元素为主要成分的生铁比纯铁硬度 (填“大”或“小”)。(4)、钾在空气中加热发生化合反应生成超氧化钾(KO2)的化学方程式为。19. NaOH、KNO3和Na2CO3在不同温度下的溶解度如表所示。物质
溶解度/g
温度℃
0
10
20
30
40
NaOH
42.0
51.0
109.0
119.0
129.0
KNO3
13.3
20.9
31.6
45.8
63.9
Na2CO3
6.0
16.0
18.0
36.5
50.0
下列实验过程中不考虑化学变化、水的蒸发和结晶水合物等因素。
(1)、10℃时,KNO3的溶解度 (填“>”,“<”或“=”)Na2CO3的溶解度。(2)、20℃时,将129gNaOH固体加入到100g水中,搅拌后固体全部消失,放置到t1时刻开始析出固体,到t2时刻析出10g固体为 (填“饱和”或“不饱和”)溶液。t2时刻溶液的温度为℃。(3)、40℃时,将等质量的三种物质的饱和溶液冷却到30℃,所得溶液中溶剂质量最多______ (填序号)。A、Na2CO3溶液 B、KNO3溶液 C、NaOH溶液20. “嫦娥五号“上使用的记忆合金、SiC颗粒增强铝基复合材料、高性能芳纶纤维等材料引起了全世界的关注。(1)、下列属于有机合成材料的是 (填序号)。A记忆合金 B羊毛 C芳纶纤维
(2)、硬度非常大的SiC,其结构类似金刚石,则构成SiC的基本粒子为 (填序号)。A分子 B原子 C离子
(3)、工业制取记忆合金中的钛,先用热浓硫酸处理钛铁矿(主要成分为FeTiO3)反应中元素化合价不变,得到硫酸钛[Ti(SO4)2]、硫酸亚铁和一种氧化物,硫酸钛中钛元素的化合价为 , 化学方程式为。三、综合题
-
21. 某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图(小部分产物略去)。

查阅资料:a.H2O2溶液可将Fe2+转化为Fe3+。
b.Fe3+ 、Ni2+转化为对应的氢氧化物沉淀时,溶液pH如图
 (1)、步骤Ⅰ的操作为。(2)、滤渣①的成分为。(3)、单质Fe参与反应的化学方程式为。(任写一个)(4)、滤液②中有Ni2+、无Fe3+ , 则滤液②pH可能为______ (填序号)。A、pH=1 B、pH=2 C、pH=6 D、pH=10(5)、Ni、Fe、Ag三种金属的活动性由强到弱的顺序为。22. 氧气的制取和性质是初中化学的重要内容,根据如图所示的装置回答问题
(1)、步骤Ⅰ的操作为。(2)、滤渣①的成分为。(3)、单质Fe参与反应的化学方程式为。(任写一个)(4)、滤液②中有Ni2+、无Fe3+ , 则滤液②pH可能为______ (填序号)。A、pH=1 B、pH=2 C、pH=6 D、pH=10(5)、Ni、Fe、Ag三种金属的活动性由强到弱的顺序为。22. 氧气的制取和性质是初中化学的重要内容,根据如图所示的装置回答问题 (1)、仪器a常用 (填“内焰”“外焰”或“焰心”)加热。(2)、用H2O2溶液和MnO2制取O2的化学方程式为。实验室里欲制取和收集一瓶干燥的O2 , 需选用的装置是(填序号)。(3)、装置E中水的作用是。(4)、若将铁丝改为少量木炭进行实验,为了检验产物,可将水换成(填名称)23. 某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。(1)、配制溶液时,加速粗盐溶解的玻璃仪器是。(2)、(探究过程)
(1)、仪器a常用 (填“内焰”“外焰”或“焰心”)加热。(2)、用H2O2溶液和MnO2制取O2的化学方程式为。实验室里欲制取和收集一瓶干燥的O2 , 需选用的装置是(填序号)。(3)、装置E中水的作用是。(4)、若将铁丝改为少量木炭进行实验,为了检验产物,可将水换成(填名称)23. 某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。(1)、配制溶液时,加速粗盐溶解的玻璃仪器是。(2)、(探究过程)
步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无杂质,向溶液中继续滴加过量Na2CO3溶液,产生白色沉淀CaCO3固体,反应的化学方程式为。(3)、步骤2:向步骤1的滤液中滴加过量BaCl2溶液,产生白色沉淀,过滤:向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是。(初步结论)杂质成分已确定,且已完全除去。
(4)、(反思交流)小东认为Na2SO4还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,若观察到的现象,证明粗盐中确实存在Na2SO4。
(5)、小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为 (填序号)。ANa2CO3溶液、BaCl2溶液 B稀盐酸、BaCl2溶液 CNaOH溶液、NaCO3溶液
四、计算题
-
24. 二氧化氯(ClO2)常用于自来水消毒,工业制取原理为 ,某工厂将30kgNaClO3固体加到100kg浓盐酸中,反应一段时间后,生成13.5kgClO2 (生成的气体全部逸出,其它物质全部形成溶液)。已知:NaClO3和ClO2的相对分子质量分别为106.5和67.5。
试计算:
(1)、NaClO3中钠元素和氧元素的质量比为;(2)、参加反应的NaClO3的质量;(3)、所得溶液中NaClO3的质量分数(计算结果精确到1%)。