河南省郑州市2021年高考化学一模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 化学与生活、科技密切相关。下列说法正确的是( )A、“歼-20”飞机上使用的碳纤维被誉为“新材料之王”,是一种新型有机高分子材料 B、2020年12月3日,在月球表面成功展开的五星红旗的主要材料芳纶属于合成纤维 C、我国海洋开发走向深蓝,“蛟龙号”外壳材料使用的钛合金属于化合物 D、2020年我国发射的嫦娥5号探月器的太阳能电池帆板的材料是2. 下列化学用语表示正确的是( )A、羟基的电子式:
 B、钠离子的结构示意图:
B、钠离子的结构示意图:  C、氯仿分子的球棍模型:
C、氯仿分子的球棍模型:  D、对硝基甲苯的结构简式:
D、对硝基甲苯的结构简式:  3. 白屈菜酸有止痛、止咳等功效,其结构简式如图。下列说法中错误的是( )
3. 白屈菜酸有止痛、止咳等功效,其结构简式如图。下列说法中错误的是( ) A、白屈菜酸分子中含有四种官能团 B、白屈菜酸的一种同分异构体能发生银镜反应 C、白屈菜酸可以发生氧化、酯化、水解反应 D、白屈菜酸分子中不含手性碳(连有4个不同原子或原子团的碳原子叫手性碳)4. NA表示阿伏加德罗常数,下列说法正确的是( )A、 的 溶液中含有 的数目为0.1 NA B、常温常压下, 和 的混合物中含有的电子数一定为NA C、常温常压下,31g白磷燃烧生成 时,断裂 键的数目为NA D、 晶体中阴、阳离子总数为0.3 NA5. 某科研人员研究得出,HCHO可在羟基磷灰石(HAP)表面催化氧化生成 和 ,其历程示意图如图(图中只画出了HAP的部分结构)。
A、白屈菜酸分子中含有四种官能团 B、白屈菜酸的一种同分异构体能发生银镜反应 C、白屈菜酸可以发生氧化、酯化、水解反应 D、白屈菜酸分子中不含手性碳(连有4个不同原子或原子团的碳原子叫手性碳)4. NA表示阿伏加德罗常数,下列说法正确的是( )A、 的 溶液中含有 的数目为0.1 NA B、常温常压下, 和 的混合物中含有的电子数一定为NA C、常温常压下,31g白磷燃烧生成 时,断裂 键的数目为NA D、 晶体中阴、阳离子总数为0.3 NA5. 某科研人员研究得出,HCHO可在羟基磷灰石(HAP)表面催化氧化生成 和 ,其历程示意图如图(图中只画出了HAP的部分结构)。
下列说法错误的是( )
A、HAP不能提高HCHO与 的平衡转化率 B、HCHO在反应过程中,有 键发生断裂 C、根据图示信息, 分子中的氧原子全部来自 D、该过程的总反应是6. 利用化学反应可以制取人们需要的物质。下列物质间的转化均能实现的是( )A、 B、 C、 D、7. 实验室模拟侯氏制碱法制取纯碱和氯化铵溶液,下列选项有关操作错误的是( )选项
A.
B.
C.
D.
实验操作




实验目的
制取氨气将其溶于饱和食盐水
用碳酸钠与稀硫酸制二氧化碳
过滤获得碳酸钠晶体
蒸发浓缩氯化铵溶液
A、A B、B C、C D、D8. 下列实验能达到预期目的的是( )实验内容
实验目的
A
向1mL 0.1mol•L-1NaOH溶液中加入2mL 0.1mol•L-1CuSO4溶液,振荡后滴加0.5mL葡萄糖溶液,加热后未出现红色沉淀
证明葡萄糖中不含醛基
B
向1mL 0.2mol•L-1AgNO3溶液中滴入2滴0.1mol•L-1KCl溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1KI溶液,又生成黄色沉淀
证明在相同温度下,Ksp(AgCl)>Ksp(AgI)
C
室温下,用pH试纸测定同浓度的Na2CO3与NaClO的pH,比较二者pH的大小
证明碳元素的非金属性弱于氯
D
将FeCl2样品溶于盐酸,滴加KSCN溶液,溶液变红色
证明FeCl2样品已变质
A、A B、B C、C D、D9. X、Y、Z、W为原子序数依次增大的4种短周期主族元素,Z元素的气态氢化物和最高价氧化物对应的水化物可以形成离子化合物。这4种元素形成某有机物的结构简式如图。下列说法正确的是( ) A、含氧酸的酸性:Z>Y B、原子半径:X<Y<Z<W C、氢化物的沸点:W>Z>Y D、这4种元素组成的一种化合物M可与盐酸反应,也可与氢氧化钠溶液反应10. 图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是( )
A、含氧酸的酸性:Z>Y B、原子半径:X<Y<Z<W C、氢化物的沸点:W>Z>Y D、这4种元素组成的一种化合物M可与盐酸反应,也可与氢氧化钠溶液反应10. 图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是( ) A、A中只含有离子键 B、B物质可以和Y反应直接转化为E C、D,E均可以用向上排空气法收集 D、通过氢氧化钠溶液可以除去D中含有的少量E11. 探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下, 的 )
A、A中只含有离子键 B、B物质可以和Y反应直接转化为E C、D,E均可以用向上排空气法收集 D、通过氢氧化钠溶液可以除去D中含有的少量E11. 探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下, 的 )实验
装置
试剂a
现象
①

Ca(OH)2溶液(含酚酞)
产生气泡
②
少量NaHCO3溶液
紫色溶液褪色
③
酸性KMnO4溶液
溶液褪色,产生白色沉淀
④
C2H5OH和浓硫酸
加热后产生有香味物质
下列离子方程式或化学方程式错误的是( )
A、草酸有酸性: B、草酸的酸性大于碳酸: C、草酸有还原性: D、草酸可发生酯化反应:HOOCCOOH+2C2H5OH C2H5OOC-COOC2H5+2H2O12. 高温下,甲烷生成乙烷的反应为 。反应在初期阶段的速率方程为v=k∙c(CH4),其中k为反应速率常数。下列说法错误的是( )A、反应初期,增加甲烷浓度,v增大 B、反应过程中H2浓度变化对速率无影响 C、该温度下,乙烷的生成速率逐渐减小 D、升高反应温度,k增大13. (环戊二烯)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法错误的是( )
(环戊二烯)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法错误的是( )  A、T1小于T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45 mol·L−114. 在油田注水系统中,钢管主要发生硫酸盐还原菌厌氧腐蚀,一种理论认为厌氧细菌可促使 与 反应生成 ,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )
A、T1小于T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45 mol·L−114. 在油田注水系统中,钢管主要发生硫酸盐还原菌厌氧腐蚀,一种理论认为厌氧细菌可促使 与 反应生成 ,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( ) A、正极的电极反应式为: B、 与 的反应可表示为: C、钢管发生厌氧腐蚀的产物主要含有 D、为减缓钢管的腐蚀,可在钢管表面镀铜15. 常温下,用 的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
A、正极的电极反应式为: B、 与 的反应可表示为: C、钢管发生厌氧腐蚀的产物主要含有 D、为减缓钢管的腐蚀,可在钢管表面镀铜15. 常温下,用 的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
下列说法正确的是( )
A、BOH的Kb约为1×10-3 B、a点的c(B+)大于b点 C、a点溶液中:c(B+)+c(H+)=2c(OH-)+c(BOH) D、滴定至pH=7时,c(B+)=c(Cl-)<0.1mol•L-1二、非选择题
-
16. 二乙酸-1,4-环己二醇酯可通过如图路线合成:
 (1)、反应①的反应条件。(2)、⑤的反应类型是 , C中官能团的名称是。(3)、写出化合物B的结构简式。(4)、写出反应⑧的化学方程式。17. 分类法是研究物质性质的重要方法。现有 、CO、 、Cu、 、 等物质,根据它们的组成及性质进行如图分类:
(1)、反应①的反应条件。(2)、⑤的反应类型是 , C中官能团的名称是。(3)、写出化合物B的结构简式。(4)、写出反应⑧的化学方程式。17. 分类法是研究物质性质的重要方法。现有 、CO、 、Cu、 、 等物质,根据它们的组成及性质进行如图分类: 请回答下列问题:(1)、淡黄色固体最终位于组,它的电子式为。该物质与水反应,若有 个电子转移,则有mol该物质参与反应。(2)、写出实验室制备Ⅰ组中气体的化学方程式。(3)、B组中的物质能与稀硝酸反应,写出该反应的离子方程式。(4)、Ⅱ组中的物质滴入水中后与水剧烈反应产生大量酸雾,写出该反应的化学方程式。18. 某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证 、 、 氧化性的强弱。根据题目要求回答下列问题:
请回答下列问题:(1)、淡黄色固体最终位于组,它的电子式为。该物质与水反应,若有 个电子转移,则有mol该物质参与反应。(2)、写出实验室制备Ⅰ组中气体的化学方程式。(3)、B组中的物质能与稀硝酸反应,写出该反应的离子方程式。(4)、Ⅱ组中的物质滴入水中后与水剧烈反应产生大量酸雾,写出该反应的化学方程式。18. 某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证 、 、 氧化性的强弱。根据题目要求回答下列问题: (1)、检查装置气密性后,关闭 、 、 ,打开 ,旋开旋塞a,加热A,则B中发生反应的离子方程式为。(2)、B中溶液变黄时,停止加热A,关闭 。打开旋塞b,使约2mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是。(3)、若要继续证明 和 氧化性的强弱,需要进行的操作是。(4)、甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序: 的是(填“甲”、“乙”或“丙”)。
(1)、检查装置气密性后,关闭 、 、 ,打开 ,旋开旋塞a,加热A,则B中发生反应的离子方程式为。(2)、B中溶液变黄时,停止加热A,关闭 。打开旋塞b,使约2mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是。(3)、若要继续证明 和 氧化性的强弱,需要进行的操作是。(4)、甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序: 的是(填“甲”、“乙”或“丙”)。过程(2)中溶液含有的离子
过程(3)中溶液含有的离子
甲
既有 又有
有
乙
有 无
有
丙
有 无
有
(5)、验证结束后,将D换成盛有NaOH溶液的烧杯,旋开 、 、 和 ,关闭旋塞a、c,打开旋塞b,从两端鼓入 ,这样做的目的是19. 钒具有广泛用途,利用含钒废催化剂(主要含有 、 和不溶性硅酸盐)制备 的新工艺流程如图:
已知:滤液1和滤液2中钒以 的形式存在。回答下列问题:
(1)、在实验室中操作Ⅰ用到的玻璃仪器有。(2)、在滤渣1中加入 和过量 溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为。(3)、混合溶液中加入 ,发生反应的离子方程式是。(4)、钒最后以 的形式沉淀出来。沉钒率( 沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是(写一条即可)。 (5)、称取w g所得产品,先用硫酸溶解,得到 溶液,再加入 的 溶液,最后用 酸性 溶液滴定过量的 至终点,消耗溶液 的体积为 。假设杂质不参与反应,锰被还原为 。则产品中 的质量分数为 , (已知 和 溶液反应的离子方程式为 )20. 甲烷和CO2是主要的温室气体,高效利用甲烷和CO2对缓解大气变暖有重要意义。(1)、图是利用太阳能将CO2分解制取炭黑的示意图:
(5)、称取w g所得产品,先用硫酸溶解,得到 溶液,再加入 的 溶液,最后用 酸性 溶液滴定过量的 至终点,消耗溶液 的体积为 。假设杂质不参与反应,锰被还原为 。则产品中 的质量分数为 , (已知 和 溶液反应的离子方程式为 )20. 甲烷和CO2是主要的温室气体,高效利用甲烷和CO2对缓解大气变暖有重要意义。(1)、图是利用太阳能将CO2分解制取炭黑的示意图: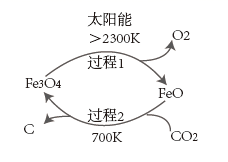
已知①
②
则过程2的热化学方程式为。
(2)、在两个体积均为2L的恒容密闭容器中,按表中相应的量加入物质,在相同温度下进行反应 的平衡转化率如表所示:容器
起始物质的量
的平衡转化率
Ⅰ
0.2
0.2
0
0
50%
Ⅱ
0.2
0.1
0.2
0.3
/
容器Ⅰ在10min时反应达到平衡,该段时间内 的平均反应速率为 ;容器Ⅱ起始时反应向(填“正反应方向”、“逆反应方向”或“不移动”)进行。
(3)、将一定量的甲烷和氧气混合发生反应 ,其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得 转化率与温度变化关系如图所示。某同学判断c点一定没有达到平衡状态,他的理由是。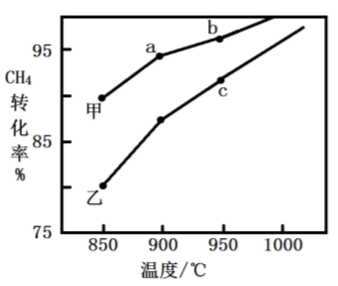 (4)、 通过催化加氢可以合成乙醇,其反应原理为: 。 ,通过实验得到如图图像:
(4)、 通过催化加氢可以合成乙醇,其反应原理为: 。 ,通过实验得到如图图像:①图1中 、 、 最高的是。
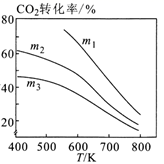
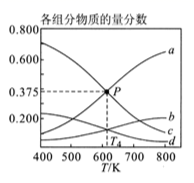
②图2表示在总压为P的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。 温度时,列式表示该反应的压强平衡常数 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 21. 氯的许多化合物是高效、广谱的灭菌消毒剂,在疫情防控中发挥了重要作用。(1)、工业制取氯气可用如图装置,图中的离子膜为膜(填“阳离子”或“阴离子”)。写出阴极的电极反应式。
21. 氯的许多化合物是高效、广谱的灭菌消毒剂,在疫情防控中发挥了重要作用。(1)、工业制取氯气可用如图装置,图中的离子膜为膜(填“阳离子”或“阴离子”)。写出阴极的电极反应式。 (2)、一种有效成分为 、 、 的“二氧化氯泡腾片”,快速溶于水后溢出大量气泡,得到 溶液。产生“气泡”的化学方程式为;生成 的离子方程式为。(3)、已知AgCl、 (砖红色)的 分别为 和 ,分析化学中,测定含氯的中性溶液中 的含量,常以 作指示剂,用标准 溶液滴定。当溶液中出现砖红色沉淀时,假设 ,则 。
(2)、一种有效成分为 、 、 的“二氧化氯泡腾片”,快速溶于水后溢出大量气泡,得到 溶液。产生“气泡”的化学方程式为;生成 的离子方程式为。(3)、已知AgCl、 (砖红色)的 分别为 和 ,分析化学中,测定含氯的中性溶液中 的含量,常以 作指示剂,用标准 溶液滴定。当溶液中出现砖红色沉淀时,假设 ,则 。