河南省郑州市2021年高考化学三模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 二十一世纪以来,随着对地堪行业的重视和新技术手段的应用,我国在矿物晶体结构和晶体化学研究方面取得飞速发展。下列有关矿石的说法中错误的是( )A、林芝矿的主要成分为FeSi2 , 林芝矿中硅的质量分数为50% B、钛铁矿的主要成分为FeTiO3 , FeTiO3的化学名称为钛酸亚铁 C、乌木石的主要成分为KAl0.33W2.67O9 , 其中钾元素可通过焰色反应检验 D、孟宪明矿的主要成分为Ca2Sn2Mg3Al8[(BO3)(BeO4)O6]2 , 是由短周期和长周期元素共同组成的2. 文献资料显示磺酸树脂催化下的烯烃二羟化反应历程如图所示:

(R1、R2、R3、R4均表示烃基或氢原子)
下列说法错误的是( )
A、该历程中有三种物质是中间产物 B、该过程的总反应类型为加成反应 C、利用该反应可以由1-己烯制备1,2-己二醇 D、 和
和  的结构完全相同
3. 短周期主族元素X、Y、Z、M、N原子序数依次增大,这五种元素形成的化合物W是一种无色晶体,是厨房中常用的鲜味调味品。下列说法正确的是( )A、原子半径:Y<Z<M<N B、氢化物稳定性:Y<Z<M C、W中的原子均达到8电子稳定结构 D、X与M形成的常见阴、阳离子均可抑制水的电离4. 某小组按如图装置探究氯气和双氧水的反应。将注射器中的浓盐酸注入试管中,在盛NaOH溶液的试管中收集到无色气体,该气体可以使带火星的木条复燃。下列说法错误的是( )
的结构完全相同
3. 短周期主族元素X、Y、Z、M、N原子序数依次增大,这五种元素形成的化合物W是一种无色晶体,是厨房中常用的鲜味调味品。下列说法正确的是( )A、原子半径:Y<Z<M<N B、氢化物稳定性:Y<Z<M C、W中的原子均达到8电子稳定结构 D、X与M形成的常见阴、阳离子均可抑制水的电离4. 某小组按如图装置探究氯气和双氧水的反应。将注射器中的浓盐酸注入试管中,在盛NaOH溶液的试管中收集到无色气体,该气体可以使带火星的木条复燃。下列说法错误的是( ) A、饱和食盐水的作用是除去氯气中的HCl B、NaOH溶液不可以用水代替 C、由反应H2O2+Cl2=2HCl+O2可证明非金属性:Cl>O D、仅根据此实验现象无法证明一定是氯气氧化了H2O25. 白云石[CaMg(CO3)2]中钙含量测定常用KMnO4滴定的方法。具体做法是将其酸溶后转化为草酸钙,过滤后用酸溶解,再用KMnO4滴定。则下列说法错误的是( )A、KMnO4滴定草酸发生反应的离子方程式为:2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O B、实验过程中两次用酸溶解,均需使用稀盐酸 C、KMnO4滴定草酸过程中,标准状况下每产生448mLCO2气体理论上转移0.02mole- D、滴定过程中若滴加KMnO4过快会发生反应4MnO +12H+=4Mn2++5O2↑+6H2O,将导致测定结果偏高6. 中国科学院唐永炳团队设计的新型铝一石墨双离子电池,工作原理如图,其放、充电的反应为:AlLi+Cx(PF6) LiPF6+xC+Al,下列说法正确的是( )
A、饱和食盐水的作用是除去氯气中的HCl B、NaOH溶液不可以用水代替 C、由反应H2O2+Cl2=2HCl+O2可证明非金属性:Cl>O D、仅根据此实验现象无法证明一定是氯气氧化了H2O25. 白云石[CaMg(CO3)2]中钙含量测定常用KMnO4滴定的方法。具体做法是将其酸溶后转化为草酸钙,过滤后用酸溶解,再用KMnO4滴定。则下列说法错误的是( )A、KMnO4滴定草酸发生反应的离子方程式为:2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O B、实验过程中两次用酸溶解,均需使用稀盐酸 C、KMnO4滴定草酸过程中,标准状况下每产生448mLCO2气体理论上转移0.02mole- D、滴定过程中若滴加KMnO4过快会发生反应4MnO +12H+=4Mn2++5O2↑+6H2O,将导致测定结果偏高6. 中国科学院唐永炳团队设计的新型铝一石墨双离子电池,工作原理如图,其放、充电的反应为:AlLi+Cx(PF6) LiPF6+xC+Al,下列说法正确的是( ) A、放电时锂离子向负极移动 B、充电时阳极反应为Al-3e-=Al3+ C、该电池负极和正极的铝均未参与电极放电 D、该电池可用LiPF6水溶液做电解质溶液7. 常温下用0.2mol·L-1NaOH溶液分别滴定0.2mol·L-1一元酸HA和HB,混合溶液的pH与离子浓度变化的关系如图所示。下列有关叙述错误的是( )
A、放电时锂离子向负极移动 B、充电时阳极反应为Al-3e-=Al3+ C、该电池负极和正极的铝均未参与电极放电 D、该电池可用LiPF6水溶液做电解质溶液7. 常温下用0.2mol·L-1NaOH溶液分别滴定0.2mol·L-1一元酸HA和HB,混合溶液的pH与离子浓度变化的关系如图所示。下列有关叙述错误的是( )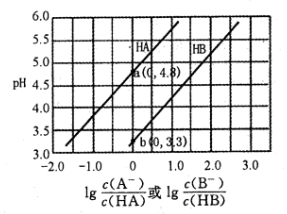 A、Ka(HA)的数量级为10-5 B、酸碱恰好反应时,HB溶液中的pH为9.15 C、反应HA+B-=HB+A-的平衡常数为10-1.5 D、相同条件下对水的电离影响程度:NaA>NaB
A、Ka(HA)的数量级为10-5 B、酸碱恰好反应时,HB溶液中的pH为9.15 C、反应HA+B-=HB+A-的平衡常数为10-1.5 D、相同条件下对水的电离影响程度:NaA>NaB二、非选择题
-
8. 某兴趣小组探究钠与水、盐酸、醋酸和乙醇反应的快慢。(1)、兴趣小组成员根据已有认知模型提出以下猜测:
猜测1:钠分别与水、盐酸反应,由于 , 钠与盐酸反应更快。
猜测2:钠分别与乙醇、醋酸反应,由于醋酸 , 钠与醋酸反应更快。
(2)、设计实验进行“证实与证伪”实验I配制一定浓度的HCl
①用12.00mol·L-1HCl配制0.50mol·L-1HCl和5.00mol·L-1HCl时,除用到烧杯、胶头滴管、玻璃棒外,还必须用到下列仪器中的(写对应字母)。

②配制0.50mol·L-1HCl250mL,需要取用12.00mol·L-1浓盐酸的体积为。
实验II相同温度下,比较钠与水、0.50mol·L-1HCl、5.00mol·L-1HCl反应的快慢
序号
钠块(形状几乎相同)
反应液体(50mL)
钠块消失时间
Ⅰ
0.15g
水
Ⅱ<Ⅰ<Ⅲ
Ⅱ
0.15g
0.50mol·L-1HCl
Ⅲ
0.15g
5.00mol·L-1HCl
该小组查阅资料知,相同温度下,影响钠与盐酸反应速率的主要因素是c(H+)和钠表面的c(Na+)。
③钠与5.00mol·L-1HCl反应,速率最慢的原因可能是。
实验II相同温度下,比较钠与乙醇、醋酸反应的快慢
序号
钠块(形状几乎相同)
反应液体(50mL)
反应现象
钠块消失时间
ⅳ
0.15g
乙醇
钠沉在烧杯底部,产生气泡较快
ⅳ<ⅴ
ⅴ
0.15g
冰醋酸
钠浮在液体表面,产生气泡较慢
④该小组某同学提出,依据化学实验的控制变量思想,该实验设计存在缺陷,该缺陷是。
⑤请你帮助该小组设计新的方案,对上述实验进行改进。
实验结论:
⑥通过实验探究,该小组同学认为钠与醋酸反应比钠与乙醇反应慢,原因可能是。
A.冰醋酸是无水乙酸,无水情况下难以电离出氢离子
B.乙醇钠在乙醇中的溶解度大于乙酸钠在乙酸中的溶解度
C.乙酸羧基中的氢原子比乙醇羟基中的氢原子更难电离出氢离子
9. 钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:
请回答下列问题:
(1)、“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有。MoS2焙烧时得到+6价钼的氧化物,焙烧时的化学方程式为。(2)、已知MoO3在碱性溶液中溶解度增大,“浸出”操作时加入Na2CO3溶液会有气体产生,用离子方程式表示气泡产生的原因。(3)、向“滤液1”中加入硝酸,调节pH为5~7,加热到65℃~70℃过滤除硅。则滤渣2的成分为。(4)、为了提高原料的利用率,工艺流程中“滤渣1”应循环到操作。(5)、“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是。(6)、“酸沉”中析出钼酸铵晶体时,加人HNO3调节pH为1.5~3,其原因是。(7)、Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式是。10. “减少碳排放,实现碳中和”是当今世界的热门话题。某课题组利用CO2和H2在催化剂的作用下合成甲醇,主要发生如下三个反应:I.CO2(g)+3H2(g)→CH3OH(g)+H2O(g)ΔH1=-49.5kJ·mol-1
II.CO2(g)+H2(g)→CO(g)+H2O(g)ΔH2=+40.9kJ·mol-1
III.……
(1)、请写出反应IIICO和H2合成CH3OH的热化学方程式。(2)、下列措施中,能提高CO2转化率的是______。A、在原料气中加入适量H2O(g) B、从体系中不断分离出甲醇 C、循环利用原料气 D、使用高效催化剂(3)、一定条件下,在某密闭容器中投人amolCO2和3amolH2 , 发生上述合成反应。达平衡容器中CH3OH的物质的量为cmol,CO的物质的量为dmol.则此条件下CO2的转化率为(列式表示,下同);甲醇的选择性(指转化为甲醇的CO2占发生反应的CO2的百分比)为;此条件下反应II的平衡常数为。 (4)、图1是反应温度对二氧化碳转化率以及甲醇选择性的影响。甲醇选择性随温度升高而降低的原因可能是。(5)、图2是一定条件下原料气的进料速度对二氧化碳转化率、甲醇选择性以及出口甲醇浓度的影响。试分析工业上实际进料速度采用2.1mol·s-1 , 而不是1.8mol·s-1 , 可能的原因是。(6)、甲醇燃料电池可用于测定阿伏加德罗常数。当甲醇燃料电池平稳工作10min后测得电池正极端消耗标准状况下氧气VL,电流稳定为XA,假设能量转化率80%,计算测得阿伏加德罗常数NA为 mol-1。(用X、V表示,已知一个电子电量为1.60×10-19C)11. 吴梦昊研究团队设计了一系列稳定的由超碱PnH 和超卤素MX 组成的PnH4MX4(Pn=N,P;M=B,Al,Fe;X=Cl,Br)超盐晶体。(1)、基态铁原子价电子排布中未成对电子数成对电子对数之比。(2)、第二周期元素中,第一电离能介于元素B和N之间的元素有种。(3)、超碱PnH 离子中PH 与PH3键角PH PH3(填“大于”或“小于”),请分析原因。(4)、写出与超卤素AlCl 等电子体的两种分子的化学式:。(5)、六方相氮化硼晶体结构与石墨相似(如图),晶体中氮原子的杂化方式为。氮化硼晶体不导电的原因是。
(4)、图1是反应温度对二氧化碳转化率以及甲醇选择性的影响。甲醇选择性随温度升高而降低的原因可能是。(5)、图2是一定条件下原料气的进料速度对二氧化碳转化率、甲醇选择性以及出口甲醇浓度的影响。试分析工业上实际进料速度采用2.1mol·s-1 , 而不是1.8mol·s-1 , 可能的原因是。(6)、甲醇燃料电池可用于测定阿伏加德罗常数。当甲醇燃料电池平稳工作10min后测得电池正极端消耗标准状况下氧气VL,电流稳定为XA,假设能量转化率80%,计算测得阿伏加德罗常数NA为 mol-1。(用X、V表示,已知一个电子电量为1.60×10-19C)11. 吴梦昊研究团队设计了一系列稳定的由超碱PnH 和超卤素MX 组成的PnH4MX4(Pn=N,P;M=B,Al,Fe;X=Cl,Br)超盐晶体。(1)、基态铁原子价电子排布中未成对电子数成对电子对数之比。(2)、第二周期元素中,第一电离能介于元素B和N之间的元素有种。(3)、超碱PnH 离子中PH 与PH3键角PH PH3(填“大于”或“小于”),请分析原因。(4)、写出与超卤素AlCl 等电子体的两种分子的化学式:。(5)、六方相氮化硼晶体结构与石墨相似(如图),晶体中氮原子的杂化方式为。氮化硼晶体不导电的原因是。 (6)、磷化硼晶胞结构如图甲所示,晶胞中P原子空间堆积方式为;已知晶体中硼和磷原子半径分别为r1pm和r2pm,距离最近的硼和磷原子核间距为二者原子半径之和。则磷化硼晶胞中原子的体积占晶胞体积的百分率为(写出计算式)。
(6)、磷化硼晶胞结构如图甲所示,晶胞中P原子空间堆积方式为;已知晶体中硼和磷原子半径分别为r1pm和r2pm,距离最近的硼和磷原子核间距为二者原子半径之和。则磷化硼晶胞中原子的体积占晶胞体积的百分率为(写出计算式)。 12. 中国科学家发现肉桂硫胺(I)是抗击新型冠状病毒的潜在用药,其合成路线如图所示:
12. 中国科学家发现肉桂硫胺(I)是抗击新型冠状病毒的潜在用药,其合成路线如图所示:
已知:①RCN RCOOH;
②碳碳双键和羟基直接连接的结构不稳定,会转化为更稳定的醛式或酮式结构。
请回答以下问题:
(1)、A的名称为。(2)、C中含有官能名称为。(3)、F的结构简式为;E+H→I的反应类型为。(4)、C→D的反应方程式为。(5)、E的同分异构体中,符合下列条件的有种(不考虑立体异构)。请写出分子中等效氢原子种类最少的同分异构体的结构简式。①能发生银镜反应;②能发生加聚反应;③分子结构中含有苯环,且只有两个取代基。
(6)、聚乳酸H OH是可降解塑料的一种。参照上述的合成路线,设计一条由乙炔为起始原料制备聚乳酸的合成路线。(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。
OH是可降解塑料的一种。参照上述的合成路线,设计一条由乙炔为起始原料制备聚乳酸的合成路线。(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。