河南省许昌市济源平顶山2021年高考化学一模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 中国青铜器在世界上享有极高声誉。所谓青铜是铜与锡或铅等元素按一定比例熔铸而成的,颜色呈青,故名青铜。青铜器在外界环境影响下所形成的腐蚀产物,由内向外为CuCl、Cu2O,再向外是CuCO3·3Cu(OH)2或CuCl2·3Cu(OH)2 , 或两者都有的层叠状结构。下列说法中错误的是( )A、青铜属于铜的一种合金,具有较高硬度 B、加入锡或铅可以降低“熔铸”时所需温度 C、青铜的主要成分为铜,铜通常呈现青色 D、青铜器外层的腐蚀物与空气中的氧气有关2. 如图所示三种烃均为稠环芳烃,下列说法错误的是( )
 A、图中每种烃的所有原子均处同一平面 B、萘的一溴代物有两种 C、蒽和菲互为同分异构体 D、萘和蒽是同系物的关系3. 实验室制备干燥氯气的装置如图所示,有关实验操作或叙述错误的是( )
A、图中每种烃的所有原子均处同一平面 B、萘的一溴代物有两种 C、蒽和菲互为同分异构体 D、萘和蒽是同系物的关系3. 实验室制备干燥氯气的装置如图所示,有关实验操作或叙述错误的是( ) A、该实验无需在烧瓶中添加沸石防止暴沸 B、用该装置可收集到纯净的氯气 C、a、b两种溶液分别为饱和食盐水和浓硫酸 D、尾气吸收装置中生成的盐有NaCl、NaClO4. 熔融碳酸盐燃料电池(MCFC)是由多孔陶瓷NiO阴极、多孔陶瓷电解质(熔融碱金属碳酸盐)隔膜、多孔金属Ni阳极、金属极板构成的燃料电池。工作时,该电池的阴极(正极)反应为O2+2CO2+4e-=2CO ,下列有关说法中错误的是( )
A、该实验无需在烧瓶中添加沸石防止暴沸 B、用该装置可收集到纯净的氯气 C、a、b两种溶液分别为饱和食盐水和浓硫酸 D、尾气吸收装置中生成的盐有NaCl、NaClO4. 熔融碳酸盐燃料电池(MCFC)是由多孔陶瓷NiO阴极、多孔陶瓷电解质(熔融碱金属碳酸盐)隔膜、多孔金属Ni阳极、金属极板构成的燃料电池。工作时,该电池的阴极(正极)反应为O2+2CO2+4e-=2CO ,下列有关说法中错误的是( )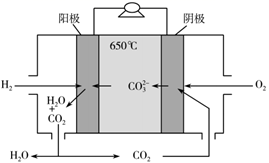 A、该电池较高的工作温度加快了阴、阳极的反应速率 B、该类电池的H2不能用CO、CH4等替代 C、该电池工作时,要避免H2、O2的接触 D、放电时,阳极(负极)反应式为2H2+2CO -4e-=2CO2+2H2O5. X、Y、Z、W为原子序数依次增大的常见元素,它们可以形成结构式如图所示的常见有机化合物Q。W元素原子最外层电子数是电子层数的3倍。下列说法正确的是( )
A、该电池较高的工作温度加快了阴、阳极的反应速率 B、该类电池的H2不能用CO、CH4等替代 C、该电池工作时,要避免H2、O2的接触 D、放电时,阳极(负极)反应式为2H2+2CO -4e-=2CO2+2H2O5. X、Y、Z、W为原子序数依次增大的常见元素,它们可以形成结构式如图所示的常见有机化合物Q。W元素原子最外层电子数是电子层数的3倍。下列说法正确的是( ) A、Z和Cl两元素的气态氢化物反应生成共价化合物 B、Y和W所形成的化合物一定能与碱溶液反应 C、化合物Q与熟石灰共热会放出刺激性气味气体 D、X和Na形成的化合物与水反应,一定会生成NaOH6. 下列实验的现象与对应结论均正确的是( )
A、Z和Cl两元素的气态氢化物反应生成共价化合物 B、Y和W所形成的化合物一定能与碱溶液反应 C、化合物Q与熟石灰共热会放出刺激性气味气体 D、X和Na形成的化合物与水反应,一定会生成NaOH6. 下列实验的现象与对应结论均正确的是( )选项
操作
现象
结论
A
将空气中燃烧的硫放入纯氧中
燃烧加剧
氧气浓度越大硫燃烧速率越快
B
常温下将Fe片放入浓硝酸中
无明显变化
Fe与浓硝酸不反应
C
充满NH3的试管倒扣于水中
试管充满水
氨水呈碱性
D
钠在空气中燃烧
火焰呈黄色
反应产物主要是Na2O
A、A B、B C、C D、D7. 用0.1000 mol·L-1 NaOH溶液分别滴定20 mL 0.1000 mol·L-1 HCl和HAc(醋酸)的滴定曲线如图。下列说法正确的是( )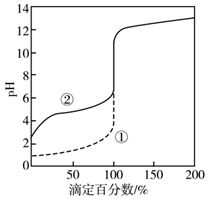 A、0.1000 mol·L-1 HAc的电离百分数约为10% B、两个滴定过程均可用甲基橙做指示剂 C、滴定百分数为50%时,曲线②溶液中c(Ac-)>c(Na+) D、图像的变化证实了Ac-的碱性很强
A、0.1000 mol·L-1 HAc的电离百分数约为10% B、两个滴定过程均可用甲基橙做指示剂 C、滴定百分数为50%时,曲线②溶液中c(Ac-)>c(Na+) D、图像的变化证实了Ac-的碱性很强二、非选择题
-
8. 常温下,苯乙酮为浅黄色油状液体,不溶于水,易溶于大多数有机溶剂;可用作树脂的溶剂和塑料工业生产中的增塑剂等。部分物质沸点、密度和制备原理如下:
沸点:苯80.1℃、石油醚30~80℃、苯乙酮202℃。
密度:苯0.88 g/mL
乙酸酐1.07 g/mL
原理:C6H6+(CH3CO)2O C6H5COCH3+CH3COOH
实验步骤:
步骤1:在50 mL的二口瓶上,按照如图所示安装恒压滴液漏斗、回流冷凝管和装有无水氯化钙的干燥管等。

在二口瓶中加入6 g无水氯化铝和8 mL纯净苯,边用磁力搅拌器搅拌边滴加2 mL乙酸酐。严格控制滴加速率,必要时用冷水冷却,待反应缓和后,加热回流并搅拌,直至无HCl气体逸出为止。
步骤2:待反应液冷却后,将其倾入盛有10 mL浓盐酸和20 g碎冰的烧杯中,使胶状物完全溶解。然后将反应液倒入分液漏斗分出上层有机相,再用20 mL石油醚进行两次萃取,萃取后合并有机相。依次用5mL10%NaOH和5mL水洗至中性,再用无水硫酸镁干燥。
步骤3:滤去干燥剂,将有机相置于100mL蒸馏烧瓶中,用加热套加热,使用不同的冷凝管进行蒸馏,先蒸出石油醚和苯,再蒸出苯乙酮。该实验得到的产品为1.64 g。
回答下列问题:
(1)、实验中使用恒压滴液漏斗滴加液体的目的为。从步骤1的操作中可以看出,苯与乙酸酐的反应为反应(填“吸热”或“放热”)。(2)、用于吸收HCl气体的烧杯中,可以使用的液体为。若其中的倒扣漏斗全部浸没于液体中,则吸收气体时会发生的现象。(3)、该实验中检验“水洗至中性”的方法为。(4)、实验室常用的冷凝管有:①球形冷凝管②直形冷凝管③空气冷凝管。当蒸气温度高于130℃时,如果用水进行冷却,因二者温差大,会造成冷凝管炸裂。该实验的蒸馏操作中,蒸出石油醚和苯时,应使用的冷凝管为(填序号,下同),蒸出苯乙酮时,应使用的冷凝管为。(5)、该实验的产率为。9. 锂电池材料的回收利用已经成为重要的研究课题。已知经过预处理的某锂电池正极材料中主要存在LiCoO2和Cu、Al和Fe,某课题组利用如图工艺流程对其进行处理。
回答下列问题:
(1)、LiCoO2中,钴元素的化合价为。实验室里通常是在铝盐溶液滴加溶液制备Al(OH)3。(2)、图中用NaOH溶液调节溶液pH,得到的固体应为。为了使该物质从溶液中完全沉淀,应控制溶液pH在3.5左右。则该物质的Ksp数值约为(已知某离子浓度小于10-5 mol·L-1 时沉淀完全)。(3)、生成Li2CO3的反应加热的目的为 , 最恰当的加热方法为。(4)、LiCoO2“酸浸”阶段发生反应的化学反应方程式为。其“酸浸”过程也可以使用盐酸完成,与使用H2SO4相比,其缺点为。经萃取分液得到的CoSO4 , 再经加碱、过滤、热分解得到Co2O3 , 实现钴的富集回收。其中热分解生成Co2O3的化学方程式是。10. 甲醇的合成是现代化工领域研究的重点。合成甲醇时,合成气成分主要包括CO、CO2、H2、H2O等净化气体和CH4、N2、Ar等惰性气体以及H2S等有害气体。这些气体成分将对甲醇产品质量以及产量造成不同程度的影响。合成过程中的部分反应如下:(i)CO(g)+2H2(g)=CH3OH(g) ∆H1=-90.1 kJ·mol-1
(ii)CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.1 kJ·mol-1
(iii)CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H3=-206 kJ·mol-1
(iv)2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4=-24.5 kJ·mol-1
(1)、反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的∆H5=。该反应的化学平衡常数表达式为。下列关于CO2在合成甲醇反应中的主要作用描述,错误的是。
A.可以抑制反应(iv)的发生 B.可以提高碳元素的利用率
C.可以提高甲醇蒸气的纯度 D.有利于合成塔冷却降温过程的进行
(2)、寻找合适的催化剂,一直是甲醇合成研究领域的重点。Saussey和Lavalley认为ZnO催化CO、H2合成CH3OH的机理如图所示。这种理论解释了合成气中少量的水提高了甲醇生成活性的事实,其理由为。Cu作催化剂合成甲醇时,杂质气体会发生反应H2S+Cu=CuS+H2 , 因为该反应是(填“可逆”或“不可逆”)的,所以会导致催化剂永久性中毒。 (3)、2020年我国科学家在甲醇合成方面,进行了大量有价值的研究。
(3)、2020年我国科学家在甲醇合成方面,进行了大量有价值的研究。①某研究报告中指出,由于甲烷的生成,导致合成塔内温度极难控制,使合成成本增加,其原因为。
②提高合成塔内反应温度,合成反应速率虽然会增大,但其平衡常数会(填“增大”或“减小”),故不同阶段会有不同的最佳温度。从理论上讲,反应初期和随着塔内甲醇浓度上升(中后期),合成塔内的最佳温度应有何不同:。实际生产中,在气压值为5.0 MPa,用铜催化剂进行催化时,随着反应进行合成塔内的最佳温度范围控制如图所示,这主要是为了保证催化剂有较高的。该合成粗甲醇的实际情况下,CO、CO2、H2三种气体的氢碳比值(气体的体积比)f应控制在5左右。已知f=(H2-CO2)/(CO+CO2),CO的体积分数应在12%以下,CO2的体积分数应在3%左右,则H2的体积分数应控制在左右。
 11. 铬(Cr)是重要的过渡元素,用于制不锈钢、汽车零件和录像带等。回答下列问题:(1)、铬位于元素周期表的第四周期,第族。Cr原子外围电子排布式为 , 它可以首先失去能级上的电子成为Cr+。(2)、铬铁尖晶石也叫铝铬铁矿,化学成分为Fe(Cr,Al)2O4 , 含Cr2O3 32%~38%,其中铁的存在用氧化物形式表示为。Fe和Cr的电负性分别为1.8和1.66,即Fe的金属性比Cr。(3)、Cr(CO)6是一种典型的羰基配合物。其配体为CO,已知CO的结构式是C O,分子中π键的数目为。已知形成Cr(CO)6时,Cr原子的杂化方式为d2sp3 , 根据原子轨道杂化规律,其杂化后形成的杂化轨道数为个,Cr(CO)6的分子立体构型为。(4)、金属铬晶体为体心立方晶胞(如图),实验测得铬的密度ρ g·cm-3 , 阿伏加德罗常数为NA mol-1。则每个晶胞中含有的Cr原子个数为 , 铬原子的半径r=pm。
11. 铬(Cr)是重要的过渡元素,用于制不锈钢、汽车零件和录像带等。回答下列问题:(1)、铬位于元素周期表的第四周期,第族。Cr原子外围电子排布式为 , 它可以首先失去能级上的电子成为Cr+。(2)、铬铁尖晶石也叫铝铬铁矿,化学成分为Fe(Cr,Al)2O4 , 含Cr2O3 32%~38%,其中铁的存在用氧化物形式表示为。Fe和Cr的电负性分别为1.8和1.66,即Fe的金属性比Cr。(3)、Cr(CO)6是一种典型的羰基配合物。其配体为CO,已知CO的结构式是C O,分子中π键的数目为。已知形成Cr(CO)6时,Cr原子的杂化方式为d2sp3 , 根据原子轨道杂化规律,其杂化后形成的杂化轨道数为个,Cr(CO)6的分子立体构型为。(4)、金属铬晶体为体心立方晶胞(如图),实验测得铬的密度ρ g·cm-3 , 阿伏加德罗常数为NA mol-1。则每个晶胞中含有的Cr原子个数为 , 铬原子的半径r=pm。 12. 苏沃雷生(Suvorexant),商品名为Belsomra,主要用于治疗原发性失眠症。我国科学家对其合成路线进行了改造性研究,改造后的合成路线如图:
12. 苏沃雷生(Suvorexant),商品名为Belsomra,主要用于治疗原发性失眠症。我国科学家对其合成路线进行了改造性研究,改造后的合成路线如图:
回答有关问题:
(1)、化合物1的名称是2-氨基。化合物2中含氧官能团的名称为。(2)、其中所用到的脱保护剂p-TsOH,为对甲基苯磺酸,它的结构简式为。(3)、氨基保护基Boc-的组成为(CH3)3COOC-,化合物5是化合物3和化合物4发生缩合反应,失水生成的,化合物4的化学式为。(4)、化合物6和化合物7发生取代反应,生成苏沃雷生和HCl,若用HR代表化合物6,则该反应的化学方程式可表示为。(5)、化合物1的核磁共振氢谱有组峰。化合物1具有相同官能团,且属于芳香类的同分异构体中,核磁共振氢谱峰数最少的异构体的结构简式为(写出1种即可)。