河南省济源平顶山许昌2021年高考化学二模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 下列关于自然界中氮循环(如图)的说法错误的是( )
 A、自然界中,含氮有机物和含氮无机物之间可以相互转化 B、氨与铵盐参与循环成为大气中的游离氮只发生氧化反应 C、工业合成氨是氮肥工业的基础,氨也是重要的工业原料 D、在自然界氮循环中,碳、氢、氧三种元素也参加了循环2. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、0.3molFe与水蒸气发生反应转移电子数为0.9NA B、标准状况下2.24L氯气溶于水,反应转移的电子数为0.1NA C、17.6g丙烷中所含的极性共价键的个数为4NA D、5g质量分数为46%的乙醇所含氢原子数为0.6NA3. 芬必得是一种高效的消炎药物,主要成分为化合物布洛芬,其结构简式如图所示,下列说法正确的是( )
A、自然界中,含氮有机物和含氮无机物之间可以相互转化 B、氨与铵盐参与循环成为大气中的游离氮只发生氧化反应 C、工业合成氨是氮肥工业的基础,氨也是重要的工业原料 D、在自然界氮循环中,碳、氢、氧三种元素也参加了循环2. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、0.3molFe与水蒸气发生反应转移电子数为0.9NA B、标准状况下2.24L氯气溶于水,反应转移的电子数为0.1NA C、17.6g丙烷中所含的极性共价键的个数为4NA D、5g质量分数为46%的乙醇所含氢原子数为0.6NA3. 芬必得是一种高效的消炎药物,主要成分为化合物布洛芬,其结构简式如图所示,下列说法正确的是( ) A、布洛芬可以发生加成、氧化、取代反应 B、布洛芬不能使酸性高锰酸钾溶液褪色 C、布洛芬的分子式为C12H18O2 D、布洛芬苯环上的一氯取代产物有四种4. 为了测定M克含有少量氯化钠杂质的碳酸钠样品的纯度,可用下图装置进行实验(部分试剂 未标明),下列有关说法错误的是( )
A、布洛芬可以发生加成、氧化、取代反应 B、布洛芬不能使酸性高锰酸钾溶液褪色 C、布洛芬的分子式为C12H18O2 D、布洛芬苯环上的一氯取代产物有四种4. 为了测定M克含有少量氯化钠杂质的碳酸钠样品的纯度,可用下图装置进行实验(部分试剂 未标明),下列有关说法错误的是( ) A、实验前要通过E鼓入空气,排尽装置中的CO2 B、实验中应先关闭弹簧夹,再向B中加入稀硫酸 C、装置D中应装入足量NaOH溶液,充分吸收CO2 D、干燥管Ⅱ的使用,提高了实验结果的准确性5. 化纤工业中聚酯生产过程会产生大量的乙醛废水。隔膜电解法是处理高浓度乙醛废水的一种新方法,可让乙醛同时在阴、阳两极发生反应。实验室以一定浓度的CH3CHO-Na2SO4溶液为电解液,模拟乙醛废水处理 过程,工作原理如图所示。下列说法正确的是( )
A、实验前要通过E鼓入空气,排尽装置中的CO2 B、实验中应先关闭弹簧夹,再向B中加入稀硫酸 C、装置D中应装入足量NaOH溶液,充分吸收CO2 D、干燥管Ⅱ的使用,提高了实验结果的准确性5. 化纤工业中聚酯生产过程会产生大量的乙醛废水。隔膜电解法是处理高浓度乙醛废水的一种新方法,可让乙醛同时在阴、阳两极发生反应。实验室以一定浓度的CH3CHO-Na2SO4溶液为电解液,模拟乙醛废水处理 过程,工作原理如图所示。下列说法正确的是( )
[已知阴极区域反应主要过程可表示为:H2O+e- =H*+OH- 、CH3CHO+2H* = CH3CH2OH (H*为活泼H)]
A、与b相连的极区发生反应:CH3CHO+H2O-2e- =CH3COOH+2H+ B、在处理废水过程中阳极区域pH逐渐增大 C、图中离子交换膜应该是阴离子交换膜 D、电解过程中阴极可能发生副反应2H2O+2e-=H2↑+2OH-6. W、X、Y、Z、M是原子序数依次增大的短周期主族元素。W元素的原子半径最小,X的氢化物可做制冷剂,Y的族序数等于周期数,Z元素最高价氧化物对应水化物是一种无色油状液体。 下列说法正确的是( )A、工业上用Y与M形成的化合物熔融电解制备单质Y B、Z单质在空气中燃烧和在纯氧中燃烧生成的产物不同 C、W、X、Z形成的一种化合物能与盐酸或NaOH反应 D、M元素简单离子的半径是同周期主族元素形成简单离子半径最大的7. 实验测得 10 mL 0. 50 mol•L -1NH4Cl溶液、10 mL 0. 50 mol•L -1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25℃时CH3COOH和NH3•H2O的电离常数均为1. 8×10-5.下列说法错误的是( )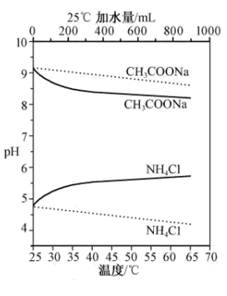 A、加水稀释初期两种盐的水解率变化程度比稀释后期大 B、图中虚线表示pH随加水量的变化,实线表示pH随温度的变化 C、将NH4Cl溶液加水稀释至浓度 mol・L-1溶液pH变化值小于lgx D、将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH )
A、加水稀释初期两种盐的水解率变化程度比稀释后期大 B、图中虚线表示pH随加水量的变化,实线表示pH随温度的变化 C、将NH4Cl溶液加水稀释至浓度 mol・L-1溶液pH变化值小于lgx D、将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH )二、非选择题
-
8. 碘是人类生命必需的微量元素,主要来源于海产品。某学习小组称取100 g海带(假设碘都以I-的形式存在),经过实验最后得到了碘的CCl4溶液。现将碘的CCl4溶液分成5等 份,进行分离碘和CCl4及测定碘含量的实验,四位同学查阅资料提出不同设计方案。资料显示:
①碘44℃开始升华;
②溶剂的沸点
物质
四氯化碳
碘
甲醇
乙醚
丙酮
沸点℃
78
184.35
64.7
34.5
56.2
③2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
方案实施如下:甲同学取其中1份混合溶液用普通蒸馏装置进行蒸馏,使四氯化碳和碘分离,结果所得溶液显紫色。
乙同学认为甲同学的萃取剂选的不合适,于是重新取海带做实验,在萃取碘单质时,用其他试剂代替四氯化碳进行萃取分液,然后再蒸馏,结果得到无色溶液。
丙同学取其中1份混合溶液按下列过程进行实验。

丁同学取1份碘的四氯化碳溶液于锥形瓶中,用C molA,Na2S2O3溶液进行滴定,重复操作 2次,平均消耗Na2S2O3 V mL。
根据上述四位同学实验回答下列问题:
(1)、甲同学蒸馏时用到的玻璃仪器有酒精灯、接引管、直形冷凝管、温度计、烧杯、、。(2)、结合资料信息,乙同学应该用作溶剂代替CCl4进行萃取,并用水浴加热控制温度(填温度范围),进行了实验。(3)、丙同学实验中:①过程A中混合液发生的离子反应方程式为。
②过程A操作是在盛有样品的分液漏斗中加入NaOH溶液,充分振荡,放气,静置分层,如图所示振荡和放气操作方法正确的是。

③过程B边加硫酸边振荡时,观察到有明显紫色蒸汽出现,原因是。继续加入硫酸,然后静置沉降,发现试管底部有较多紫黑色固体。说明碘离子已经全部转化的操作是。
(4)、丁同学实验中:①滴定终点的现象是。
②海带中碘含量为。
9. 钛铁铳矿可有效富集回收矿石中铁、钛、钪金属,获得铁精矿、钛精矿、钪精矿等主产品。从钛铁钪矿(主要成分有Sc2O3、FeTiO3、SiO2等)中制备草酸铳晶[Sc2(C2O4)3•5H2O]流程如下: 已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O Sc(HA2)3•xH2O+3H+
已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O Sc(HA2)3•xH2O+3H+Sc(HA2)3•xH2O+xTBP Sc(HA2)3•xTBP+xH2O
②常温下Sc(OH)3的Ksp约为1.0×10-31
请回答下列问题:
(1)、酸浸时为了提高酸浸速率,可釆取的措施(任一条即可),滤渣的主要成分为。(2)、酸浸时“FeTiO3”溶解的离子方程式为。(3)、步骤①的操作是浓缩、冷却、、洗涤、干燥。(4)、步骤②加大量的水稀释,同时加热的原因为 , 写岀步骤②的化学方程式.(5)、“反萃取”的化学方程式为。(6)、称取2.22g步骤③得到的草酸钪晶体[Sc2(C2O4)3•5H2O],在一定温度下加热得到0.69g固体,通过计算确定固体成分化学式为。(7)、常温下,使0.1mol/LScCl3溶液中钪离子开始沉淀时的pH为。10. NOx的含量是空气质量的一个重要指标,减少NOx的排放有利于保护环境。(1)、I. SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟雾中NOx分解成无害的N2和H2O的干法脱硝技术。①4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) ∆H1= -907. 28 kJ/mol
② 4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ∆H2 = -1269. 02 kJ/mol
③4NH3(g) + 6NO(g) = 5N2(g) + 6H2O(g) ∆H3
反应③∆H3=。
(2)、现向某2 L密闭容器中分别投入一定量的NH3、NO发生反应③,其他条件相同时,在 甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图1所示。工业上应选择 催化剂(填“甲”或“乙”),原因是。在催化剂甲的作用下,温度高于210℃时,NO转化率降低的可能原因 (3)、在密闭容器中加入4 mol NH3和3 molNO2气体,发生反应:
(3)、在密闭容器中加入4 mol NH3和3 molNO2气体,发生反应:8NH3(g) + 6NO2(g) 7N2(g) + 12H2O(g) ∆H<0,维持温度不变,不同压强下反应经过 相同时间,NO2的转化率随着压强变化如图2所示,下列说法错误的是___________。
A、维持压强980 kPa更长时间,NO2的转化率大于40% B、容器体积:Vc∶Vb=8∶9 C、反应速率:b点v正>a点v逆 D、在时间t内,若要提高NO2的转化率和反应速率,可以将H2O(g)液化分离(4)、II.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s) + 2NO2(g) N2(g) + 2CO2(g) ∆H<0
某实验室模拟该反应,在2 L恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持 温度为T1℃,反应开始时压强为800 kPa,平衡时容器内气体总压强增加25%。则用平 衡分压代替其平衡浓度表示化学平衡常数KP=kPa。[已知:气体分压(P分)=气体总压(P总)×体积分数]
(5)、已知该反应的正反应速率方程v正=k正・p2(NO2),逆反应速率方程为v逆=k逆• p(N2)•p2(CO2), 其中k正、k逆分别为正逆反应速率常数。则图3(lgk表示速率常 数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随 变化关系的斜线是。能表示lgk逆随 变化关系的斜线是。若将一定量的C和NO2投入到密闭容器中,保持温度T1℃、 恒定在压强800 kPa发生该反应,则当NO2的转化率为40%时,v逆∶v正=。(结果保留一位有效数字) 11. 钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。(1)、钛在周期表中的位置 , 钛原子核外有种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为。(2)、已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是。(3)、硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为 , 该晶体中阴离子的空间构型为。
11. 钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。(1)、钛在周期表中的位置 , 钛原子核外有种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为。(2)、已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是。(3)、硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为 , 该晶体中阴离子的空间构型为。 (4)、Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为 , B原子的杂化方式是 , 其中的BH 可由BH3和H-结合而成。BH 含有 (填序号)
(4)、Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为 , B原子的杂化方式是 , 其中的BH 可由BH3和H-结合而成。BH 含有 (填序号)①σ键 ②π键 ③氢键 ④配位健 ⑤离子键
(5)、单质钛晶体的晶胞结构如图2所示,则钛的这种堆积方式称为 , 若钛原子半径为r pm,NA表示阿伏加德罗常数的值,金属钛的密度为g/cm3(列出计算式即可)12. 磷酸氯喹可用于新型冠状病毒肺炎的治疗,磷酸氯喹可由氯喹和磷酸在一定条件下制得。氯喹J的合成路线如下:
已知:①当苯环有RCOO-、烃基、-X(X表示卤素原子)时,新导入的基团进入原有基团的邻位或对位,原有基团为—COOH、-NO2时,新导入的基团进入原有基团的间位;
②苯酚、苯胺(
 )易氧化;
)易氧化;③苯胺和甲基吡啶(
 )互为同分异构体,并且具有芳香性。(1)、由A生成B化学方程式为。(2)、由B生成C所需试剂是。(3)、C的名称 , D中所含官能团的名称为。(4)、由F生成G的(1)反应的化学方程式。(5)、由I生成J的反应类型为。(6)、M是D的一种芳香同分异构体,满足下列条件的M有种(不包含D物质)
)互为同分异构体,并且具有芳香性。(1)、由A生成B化学方程式为。(2)、由B生成C所需试剂是。(3)、C的名称 , D中所含官能团的名称为。(4)、由F生成G的(1)反应的化学方程式。(5)、由I生成J的反应类型为。(6)、M是D的一种芳香同分异构体,满足下列条件的M有种(不包含D物质)①分子结构中含一个六元环,且环上有两个取代基;
②氯原子和碳原子相连。
其中核磁共振氢谱有3组峰,且峰面积之比为1:1:1的物质的结构简式为。
(7)、设计以 为原料制备
为原料制备  的合成路线(无机试剂任选) 。
的合成路线(无机试剂任选) 。