重庆市2021年高考化学一模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 《天工开物》是我国珍贵的科技文献,下列记载中主要过程不涉及化学反应的是( )A、凡石灰经火焚炼为用 B、烧铁器淬于胆矾水中,即成铜色也 C、凡墨烧烟凝质而为之 D、水沙中所出,大者名狗头金2. 化学与生产、生活密切相关,下列物质用途错误的是( )A、次氯酸钠:漂白剂 B、碳酸氢钠:侯氏制碱法的初始原料 C、硅酸钠:木材防火剂 D、过氧化钠:呼吸面具的供氧剂3. 用括号中注明的方法分离下列各组混合物,其中正确的是( )A、碘的四氯化碳溶液(分液) B、氢氧化铁胶体和水(过滤) C、 和 (溶解过滤,再蒸发结晶) D、氮气和氧气(蒸馏)4. 下列事实能用勒夏特列原理解释的是( )A、铜与浓硫酸反应需要加热 B、加热蒸干FeCl3溶液最终得到Fe(OH)3 C、使用催化剂提高合成氨的生产效率 D、钢管与铜管堆放一处,钢管更易腐蚀5. 下列说法中正确的是( )A、 、 、 、 的熔点逐渐升高 B、 的挥发破坏了共价键 C、 的结构式为 D、 比 稳定,是因为水分子间能形成氢键6. 下列各组离子在溶液中能大量共存的是( )A、 、 、 、 B、 、 、 、 C、 、 、 、 D、 、 、 、7. 已知 转化为 和 分步进行:① ,② ,其反应过程能量变化如图所示,下列说法错误的是( )
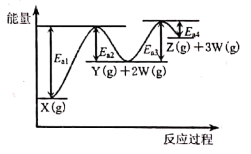 A、Ea1是反应①的活化能 B、 的能量一定低于 的能量 C、 D、反应②更容易发生,气体 很难大量累积8. 下列用于解释事实的化学用语书写正确的是( )A、氯气溶于水:Cl2+H2O⇌2H++Cl-+ClO- B、明矾[KAl(SO4)2∙12H2O]作净水剂:Al3++3H2O⇌Al(OH)3↓+3H+ C、铜作电极电解NaCl溶液初始阶段:Cu+2H2O Cu(OH)2+H2↑ D、饱和Na2CO3溶液处理水垢中的CaSO4:Ca2++CO =CaCO3↓9. 合成氨是催化界的经典反应,数次诺贝尔奖的获得,说明其从工业应用到机理认识都有着重要意义。当前,利用电化学手段进行氨的合成是人类化学控制合成的新目标,一种电化学合成氨的装置(惰性电极)示意图如图所示。下列说法正确的是( )
A、Ea1是反应①的活化能 B、 的能量一定低于 的能量 C、 D、反应②更容易发生,气体 很难大量累积8. 下列用于解释事实的化学用语书写正确的是( )A、氯气溶于水:Cl2+H2O⇌2H++Cl-+ClO- B、明矾[KAl(SO4)2∙12H2O]作净水剂:Al3++3H2O⇌Al(OH)3↓+3H+ C、铜作电极电解NaCl溶液初始阶段:Cu+2H2O Cu(OH)2+H2↑ D、饱和Na2CO3溶液处理水垢中的CaSO4:Ca2++CO =CaCO3↓9. 合成氨是催化界的经典反应,数次诺贝尔奖的获得,说明其从工业应用到机理认识都有着重要意义。当前,利用电化学手段进行氨的合成是人类化学控制合成的新目标,一种电化学合成氨的装置(惰性电极)示意图如图所示。下列说法正确的是( )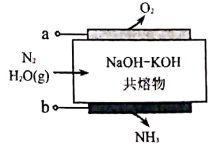 A、 电极连接电源的负极 B、 电极的电极反应式为: C、当有 生成时,理论上产生 D、电流从 极经共熔物到 极,再经电源流回 极10. 因具有杀菌能力强,对人体、动物没有危害以及对环境不造成二次污染等特点,备受人们的青睐。下图是一种制 的微观示意图。下列有关说法正确的是( )
A、 电极连接电源的负极 B、 电极的电极反应式为: C、当有 生成时,理论上产生 D、电流从 极经共熔物到 极,再经电源流回 极10. 因具有杀菌能力强,对人体、动物没有危害以及对环境不造成二次污染等特点,备受人们的青睐。下图是一种制 的微观示意图。下列有关说法正确的是( ) A、该反应中只有共价键的断裂与形成 B、该反应中, 作氧化剂 C、该条件下,氧化性: D、制取 ,有 失去电子11. 主族元素 、 、 、 的原子序数依次增大,且均不大于20。 、 原子序数之和是 的一半; 与 同主族; 的最高正价与最低负价代数和为2; 的单质是我国古代四大发明之一黑火药的一种成分。下列说法正确的是( )A、简单离子半径: B、c、d两元素形成的化合物 只含有离子键 C、a与b形成的最简单化合物的水溶液呈碱性 D、b、c两种元素的氧化物对应的水化物均为强酸12. 为阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为 B、常温下, 铁片与足量浓硫酸反应转移的电子数为 C、标准状况下, 甲烷和乙烯的混合气体中所含碳氢键数目为 D、常温下, 的 溶液中,水电离出的 数目为13. 下列各组实验中,根据实验现象所得结论正确的是( )
A、该反应中只有共价键的断裂与形成 B、该反应中, 作氧化剂 C、该条件下,氧化性: D、制取 ,有 失去电子11. 主族元素 、 、 、 的原子序数依次增大,且均不大于20。 、 原子序数之和是 的一半; 与 同主族; 的最高正价与最低负价代数和为2; 的单质是我国古代四大发明之一黑火药的一种成分。下列说法正确的是( )A、简单离子半径: B、c、d两元素形成的化合物 只含有离子键 C、a与b形成的最简单化合物的水溶液呈碱性 D、b、c两种元素的氧化物对应的水化物均为强酸12. 为阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为 B、常温下, 铁片与足量浓硫酸反应转移的电子数为 C、标准状况下, 甲烷和乙烯的混合气体中所含碳氢键数目为 D、常温下, 的 溶液中,水电离出的 数目为13. 下列各组实验中,根据实验现象所得结论正确的是( )选项
实验操作和实验现象
结论
A
向 和 的混合溶液中滴入酸化的 溶液,混合溶液变红
氧化性:
B
向盛某盐溶液的试管中滴入浓氢氧化钠溶液并加热,试管口处湿润的红色石蕊试纸变蓝
该盐中含有
C
将稀盐酸滴入 溶液中,溶液中出现凝胶
非金属性:
D
将红热的炭放入浓硫酸中,产生的气体通入澄清石灰水,石灰水变浑浊
碳被氧化成
A、A B、B C、C D、D14. 用硫酸渣(主要含 、 ,杂质为 和 等)为原料制备氢氧化氧铁( )的流程如下: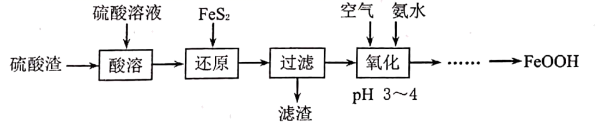
下列说法错误的是( )
A、滤渣中一定含有 B、“还原”时可以用铁粉代替 C、“氧化”的目的是将二价铁氧化成三价铁 D、“……”一系列操作为蒸发浓缩、冷却结晶二、综合题
-
15. 丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
Ⅰ.丙烷氧化脱氢法:
Ⅱ.丙烷无氧脱氢法:
请回答下列问题:
(1)、已知 ,由此计算 。(2)、在催化剂作用下, 氧化脱氢除生成 外,还生成CO、 等物质。 的转化率和 的产率随温度变化关系如图所示。
①图中 的转化率随温度升高而上升的原因是。
②在550℃时, 的选择性为。(保留1位小数)( 的选择性 )。
③ 的选择性:550℃575℃(填“大于”或“小于”)。
(3)、某温度下,在刚性密闭容器中充入 发生无氧脱氢制备丙烯。①下列能说明该反应达到平衡状态的是。
a.
b.容器内气体的密度不再发生变化
c.容器内气体平均相对分子质量不再变化
d.容器内的压强不再发生变化
②若起始时容器内压强为 ,反应达平衡后总压为 ,则 的平衡转化率为 , 该反应的压强平衡常数 (保留1位小数)。
16. 近年来,长江流域总磷超标的问题逐渐凸显,“三磷”(磷矿、磷肥和含磷农药制造等磷化工企业、磷石膏库)导致的区域环境污染问题日益受到关注。 、 和 是磷的三种含氧酸,请回答下列问题:(1)、次磷酸不能与高铁酸钾混合使用,原因是二者会发生如下反应,请配平该反应。(2)、某含磷废水的主要成分为 和 ,向废水中加入适量漂白粉,再加入生石灰调节 ,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是;若测得处理后的废水中 , 的含量为 ,则 。(3)、25℃时,向一定体积的亚磷酸( ,二元弱酸)溶液中滴加等物质的量浓度的 溶液,混合液中含磷粒子的物质的量分数(δ)与溶液 的关系如图所示。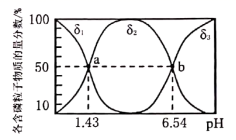
① 为(填“正盐”或“酸式盐”),其溶液显碱性的离子方程式为。
② 点时,溶液中水电离出的 。
③所加 溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为。
④将浓度均为 的 和 的混合液加水稀释10倍后,溶液中 将(填“增大”、“减小”或“不变”)。
17. 在石墨材料性能提升的帮助下,锂离子电池的性能也得到了大幅提升,华为公司曾开发出石墨烯锂离子电池,其工作原理如图1所示,该锂离子电池正极铝钴膜主要含有 、 等,处理该正极废料的一种流程如图2所示:
请回答下列问题:
(1)、“碱浸”时发生反应的离子方程式为。(2)、滤渣的主要成分的化学式为。(3)、“酸溶”时 的作用是 , “酸溶”时温度不宜过高的原因是。盐酸可以代替 和 的混合液,但工业上都不采用盐酸,其原因是。(4)、用图1中锂离子电池作电源电解制备 的装置如图3所示,d与锂离子电池的极相连(填“a”或“b”),电解池中发生的总反应离子方程式为。当锂离子电池中有 移向正极时,电解池中阴极区溶液质量的变化量为g。18. 草酸可作还原剂、沉淀剂、金属除锈剂、织物漂白剂等。实验室用电石(主要成分 ,少量 杂质)为原料制取 的装置如图所示。已知: 。请回答下列问题: (1)、装置B中的试剂名称是。(2)、装置C中多孔球泡的作用是 , 装置D的作用是。(3)、装置C中生成 的化学方程式为。(4)、从装置C中得到产品,需经过蒸发浓缩、冷却结晶、过滤、洗涤及干燥;其中洗涤的具体操作是。(5)、准确称取 产品于锥形瓶中,加入适量蒸馏水溶解,再加入少量稀硫酸,然后用 酸性 标准溶液进行滴定,消耗标准溶液 。(杂质不参与反应)
(1)、装置B中的试剂名称是。(2)、装置C中多孔球泡的作用是 , 装置D的作用是。(3)、装置C中生成 的化学方程式为。(4)、从装置C中得到产品,需经过蒸发浓缩、冷却结晶、过滤、洗涤及干燥;其中洗涤的具体操作是。(5)、准确称取 产品于锥形瓶中,加入适量蒸馏水溶解,再加入少量稀硫酸,然后用 酸性 标准溶液进行滴定,消耗标准溶液 。(杂质不参与反应)①盛装 标准溶液的滴定管名称是 , 滴定终点的现象是。
②产品中 的质量分数为。
19. “海南沉香,一片万钱,冠绝天下。”在《本草纲目》中,明代名医李时珍曾这样盛赞海南沉香。香料的使用,在我国具有悠久的历史,如下是一种香料H(分子式为C13H14O2)的合成流程,请回答下列问题: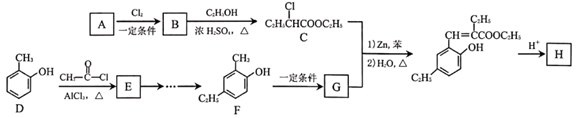
已知:①RCHO+R′CH2Cl RCH=CHR
②
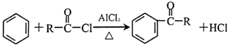
③R1COOR2+R3OH R1COOR3+R2OH
(1)、A中官能团名称是 , D→E的反应类型是。(2)、B→C的化学方程式为。(3)、D的名称是 , G的结构简式为。(4)、H与足量NaOH溶液共热的化学方程式为。(5)、有机物X为E的同分异构体,满足下列条件的X结构简式为。①能与FeCl3溶液发生显色反应 ②能发生银镜反应 ③苯环上只有一种化学环境的氢原子
(6)、请设计合理路线,以乙醇和苯为有机原料合成CH3CH=CHCH2OH,其他无机试剂任选。