云南省昆明市2021年高考化学三模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 材料与生产、生活密切相关。下列说法错误的是( )A、高纯硅可用作太阳能电池板材料 B、新版人民币油墨中含有的Fe3O4具有磁性 C、口罩中熔喷布的主要材料聚丙烯是纯净物 D、天眼反射镜中使用的金刚砂属于新型无机非金属材料2. 肉桂果实中含有的丁香醛常用于医药、香料,其结构如图所示。下列关于丁香醛的说法正确的是( )
 A、是苯的同系物 B、分子式为C9H2O4 C、所有原子共平面 D、能发生氧化、加成、取代反应3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2g氖气含有0.1NA个氖原子 B、常温常压下,18g重水(D2O)含有的电子数为10NA C、标准状况下,22.4LCl2与足量的铁反应,转移的电子数为NA D、一定条件下,1molN2与足量的H2充分反应,生成2NA个NH3分子4. 利用所给的药品和主要玻璃仪器,不能达到实验目的的是( )
A、是苯的同系物 B、分子式为C9H2O4 C、所有原子共平面 D、能发生氧化、加成、取代反应3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2g氖气含有0.1NA个氖原子 B、常温常压下,18g重水(D2O)含有的电子数为10NA C、标准状况下,22.4LCl2与足量的铁反应,转移的电子数为NA D、一定条件下,1molN2与足量的H2充分反应,生成2NA个NH3分子4. 利用所给的药品和主要玻璃仪器,不能达到实验目的的是( )选项
实验目的
药品
主要玻璃仪器
A
除去KI晶体中混有的I2
烧杯、圆底烧瓶、酒精灯
B
除去SO2中混有的HCl
饱和Na2SO3溶液
洗气瓶
C
除去BaSO4中混有的BaCl2
水
漏斗、玻璃棒、烧杯
D
除去乙酸乙酯中混有的乙酸
饱和Na2CO3溶液
分液漏斗、烧杯
A、A B、B C、C D、D5. 室温下,分别向体积均为20mL、浓度均为0.1mol·L-1的HX、HY溶液中,滴加相同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。随着Ba(OH)2溶液的加入,由水电离产生的c(H+)的变化趋势如图所示。下列说法错误的是( ) A、相同条件下,Ka(HX)>Ka(HY) B、M点溶液显中性,溶液中c(Y-)<c(Ba2+) C、N点对应Ba(OH)2溶液的体积为10mL D、T点溶液中阴离子浓度之和大于M点6. 某兴趣小组利用电化学原理降解酸性废水中的NO ,装置如图所示。下列说法正确的是( )
A、相同条件下,Ka(HX)>Ka(HY) B、M点溶液显中性,溶液中c(Y-)<c(Ba2+) C、N点对应Ba(OH)2溶液的体积为10mL D、T点溶液中阴离子浓度之和大于M点6. 某兴趣小组利用电化学原理降解酸性废水中的NO ,装置如图所示。下列说法正确的是( ) A、Pt电极可用Cu电极代替 B、负极反应式为:2NO +10e-+12H+=N2+6H2O C、溶液中电子通过质子交换膜由Ag电极向Pt电极移动 D、若外电路转移1mol电子,则膜两侧电解液质量共减少38.3g7. 短周期主族元素W、X、Y、Z原子序数依次增大,Y、W分别是短周期主族元素中原子半径最大和最小的两种元素,X2-、Y+的简单离子核外电子排布相同,由W、X、Z三种元素形成的化合物M的结构如图所示。下列说法正确的是( )
A、Pt电极可用Cu电极代替 B、负极反应式为:2NO +10e-+12H+=N2+6H2O C、溶液中电子通过质子交换膜由Ag电极向Pt电极移动 D、若外电路转移1mol电子,则膜两侧电解液质量共减少38.3g7. 短周期主族元素W、X、Y、Z原子序数依次增大,Y、W分别是短周期主族元素中原子半径最大和最小的两种元素,X2-、Y+的简单离子核外电子排布相同,由W、X、Z三种元素形成的化合物M的结构如图所示。下列说法正确的是( ) A、ZX2可以与水反应制得M B、最简单氢化物的稳定性:X<Z C、X与Y形成的化合物中阴、阳离子个数比为1:2 D、简单离子半径大小顺序为:Y>X
A、ZX2可以与水反应制得M B、最简单氢化物的稳定性:X<Z C、X与Y形成的化合物中阴、阳离子个数比为1:2 D、简单离子半径大小顺序为:Y>X二、非选择题
-
8. 氮化锂(Li3N)是重要的储氢材料,遇水剧烈反应。某研究小组设计实验制备氮化锂并测定其纯度。(1)、I.制备氮化锂

实验室用NH4Cl溶液和NaNO2溶液共热制备N2 , 装置A可选择(填标号)。
 (2)、仪器D的名称是 , 盛装的药品是。(3)、II.测定Li3N产品纯度
(2)、仪器D的名称是 , 盛装的药品是。(3)、II.测定Li3N产品纯度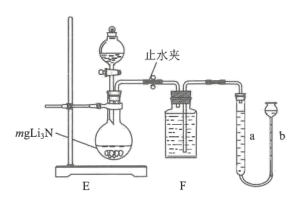
向圆底烧瓶中加水的操作是,。
(4)、氮化锂与水反应的化学方程式为 , F中液体可以选择(填“水”“石蜡油”或“饱和食盐水”)。(5)、反应结束冷却至室温后,读数前应先 , 测得体积为VL(已折合成标准状况)。若杂质与水反应不产生气体,则Li3N的质量分数为(只列出含m和V的计算式,不必计算化简)。9. 钴在硬质高温合金、催化剂等高新技术领域有广泛应用。从某炼锌厂的废渣(含Zn、Co、Fe、ZnO、SiO2等)中回收钴的一种工艺流程如图:
相关金属离子[Co(Mn+ )=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
金属离子
Co2+
Fe2+
Fe3+
Zn2+
开始沉淀的pH
7.15
6.3
1.5
6.2
沉淀完全的pH
9.15
8.3
2.8
8.2
回答下列问题:
(1)、滤渣1是 , “加热酸浸”时为确保安全应注意。(2)、若无氧化步骤,对实验的影响是。试剂X可以为下列物质中的。A.KOH B.Zn(OH)2 C.ZnO D.Na2CO3
(3)、操作1的名称是 , 从流程信息分析,在有机溶剂M中(填“ZnSO4”或“CoSO4”)溶解度更大。操作2是蒸发浓缩、冷却结晶、。(4)、工业上也可利用次氯酸钠氧化Co2+生成Co(OH)3沉淀,实现钴的回收。该反应的离子方程式是 , 若将次氯酸钠改为Na2S2O8(还原产物为SO ),则氧化剂与还原剂的物质的量之比为。(5)、常温下,已知Co(OH)3的溶度积常数为Ksp,则Co3+完全沉淀时[c(Co3+)<10-5mol·L-1],溶液的pH至少为(用含Ksp的式子表示)。10. 大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。臭氧是理想的烟气脱硝剂,其脱硝反应之一为:NO(g)+O3(g)⇌NO2(g)+O2(g)∆H=-200.9kJ·mol-1(1)、若NO(g)+1/2O2(g)=NO2(g)∆H=-58.2kJ·mol-1 , 则反应3NO(g)+O3(g)=3NO2(g)的∆H=kJ·mol-1。(2)、对于反应NO(g)+O3(g)⇌NO2(g)+O2(g),在不同温度下,分别向10L的恒容密闭容器中按1:1充入一定量的NO和O3发生反应,其中NO的物质的量随时间变化如图所示:
①写出一种既能加快化学反应速率,又能增大NO转化率的方法。
②图中T1T2(填“>”“<”或“=”)。
③温度为T1时,用NO表示t1~t2s内该反应的平均速率为 , 该反应的平衡常数K为 , 若NO的起始投入量为3amol,则达到平衡时NO的残留量为mol。
(3)、NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为。 11. 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3 , 回答下列问题:(1)、基态Rh原子的价电子排布式为4d85s1 , 铑在周期表的位置是 , 其原子中的未成对电子数为。(2)、1mol丙烯(CH3CH=CH2)中σ键的数目为 , 其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为。(3)、第一电离能PCl(填“大于”或“小于”),PPh3是
11. 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3 , 回答下列问题:(1)、基态Rh原子的价电子排布式为4d85s1 , 铑在周期表的位置是 , 其原子中的未成对电子数为。(2)、1mol丙烯(CH3CH=CH2)中σ键的数目为 , 其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为。(3)、第一电离能PCl(填“大于”或“小于”),PPh3是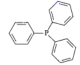 的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。 (4)、RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。 (4)、RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):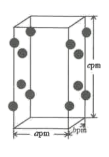
①晶胞中含有的Cl-数目为;
②若阿伏加德罗常数为NA , 则晶体的密度为g·cm-3.(列出计算式)
12. “拟人化分子-纳米小人(如图1)的合成”被称为最奇葩创意研究。其上半身合成路线如图2:
 (1)、A的化学名称为 , C的分子式为。。(2)、B的结构简式为 , B→C的反应类型为。(3)、D中含氧官能团的名称为 , E与足量氢气反应后的产物有个手性碳(注:连有四个不同的原子或基团的碳)。(4)、D生成E的化学方程式为。(5)、B的属于芳香族化合物的同分异构体有多种,其中核磁共振氢谱有两组峰的是(写出其中一种的结构简式)。(6)、高分子化合物是有重要用途的一类物质。试设计以A(
(1)、A的化学名称为 , C的分子式为。。(2)、B的结构简式为 , B→C的反应类型为。(3)、D中含氧官能团的名称为 , E与足量氢气反应后的产物有个手性碳(注:连有四个不同的原子或基团的碳)。(4)、D生成E的化学方程式为。(5)、B的属于芳香族化合物的同分异构体有多种,其中核磁共振氢谱有两组峰的是(写出其中一种的结构简式)。(6)、高分子化合物是有重要用途的一类物质。试设计以A( )和乙二醇(
)和乙二醇(  )为原料合成
)为原料合成  的流程。
的流程。