西藏拉萨市2021年高考化学二模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 2020年11月10日,第三届中国国际进口博览会闭幕,该届“进博会”新设公共卫生防疫专区、智慧出行专区、节能环保专区和体育用品及赛事专区。下列有关卫生防疫知识的描述错误的是( )A、家庭餐具可采取开水蒸煮的方式进行热力消毒 B、“84”消毒液的成分为NaClO、表面活性剂和水等,使用“84”消毒液的浓度越高越好 C、医用酒精应密封保存并远离明火 D、H2O2消毒液和ClO2泡腾片的消毒原理相同2. 柠檬酸是一种重要的有机酸,在食品业、化妆业应用广泛,其结构简式如图所示。下列说法正确的是( )
 A、柠檬酸的分子式为C6H10O7 B、柠檬酸与羟基乙酸(HO-CH2COOH)互为同系物 C、柠檬酸分子中所有原子不可能处于同一平面 D、1mol柠檬酸与足量NaOH溶液反应,最多消耗4molNaOH3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、30gC2H6中含有极性共价键的数目为7NA B、标准状况下,11.2LHF中含有质子的数目为5NA C、5.6gFe与足量稀硝酸反应,转移电子的数目为0.2NA D、7.8gNa2S和Na2O2的混合物中,含有阴离子的数目为0.1NA4. 下列关于实验操作或现象的说法正确的是( )
A、柠檬酸的分子式为C6H10O7 B、柠檬酸与羟基乙酸(HO-CH2COOH)互为同系物 C、柠檬酸分子中所有原子不可能处于同一平面 D、1mol柠檬酸与足量NaOH溶液反应,最多消耗4molNaOH3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、30gC2H6中含有极性共价键的数目为7NA B、标准状况下,11.2LHF中含有质子的数目为5NA C、5.6gFe与足量稀硝酸反应,转移电子的数目为0.2NA D、7.8gNa2S和Na2O2的混合物中,含有阴离子的数目为0.1NA4. 下列关于实验操作或现象的说法正确的是( ) A、图1:进行氢氧化铁胶体的电泳实验,通电后,阴极附近颜色逐渐加深 B、图2:反应一段时间后,试管中固体变为红棕色 C、图3:测定氯水的pH D、图4:接近滴定终点时,滴定管的尖嘴不可以接触锥形瓶内壁5. 下列有关离子方程式的书写错误的是( )A、向饱和NaCl溶液中依次通入足量NH3与CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH B、向硫酸铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH C、碳酸氢镁溶液与足量氢氧化钠溶液反应:Mg2++2HCO +4OH-=Mg(OH)2↓+2CO +2H2O D、草酸与足量酸性高锰酸钾溶液反应:2MnO +5C2O +16H+=2Mn2++10CO2↑+8H2O6. 镁-锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变,工作原理如图所示。下列有关说法错误的是( )
A、图1:进行氢氧化铁胶体的电泳实验,通电后,阴极附近颜色逐渐加深 B、图2:反应一段时间后,试管中固体变为红棕色 C、图3:测定氯水的pH D、图4:接近滴定终点时,滴定管的尖嘴不可以接触锥形瓶内壁5. 下列有关离子方程式的书写错误的是( )A、向饱和NaCl溶液中依次通入足量NH3与CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH B、向硫酸铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH C、碳酸氢镁溶液与足量氢氧化钠溶液反应:Mg2++2HCO +4OH-=Mg(OH)2↓+2CO +2H2O D、草酸与足量酸性高锰酸钾溶液反应:2MnO +5C2O +16H+=2Mn2++10CO2↑+8H2O6. 镁-锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变,工作原理如图所示。下列有关说法错误的是( ) A、放电时,Cl-向上层方向移动 B、放电时,Mg(液)层的质量减小。 C、充电时,Mg-Sb(液)层作阴极 D、充电时,阴极的电极反应式为Mg2++2e-=Mg7. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,W与Y同主族;X是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )A、原子半径:X>Y>W B、最高价氧化物对应水化物的酸性:Z>Y>W C、X、Y的常见氧化物均能与NaOH溶液反应 D、化合物WZ2中各原子均满足鼓外层8电子稳定结构
A、放电时,Cl-向上层方向移动 B、放电时,Mg(液)层的质量减小。 C、充电时,Mg-Sb(液)层作阴极 D、充电时,阴极的电极反应式为Mg2++2e-=Mg7. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,W与Y同主族;X是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )A、原子半径:X>Y>W B、最高价氧化物对应水化物的酸性:Z>Y>W C、X、Y的常见氧化物均能与NaOH溶液反应 D、化合物WZ2中各原子均满足鼓外层8电子稳定结构二、非选择题
-
8. 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应生成SO2和HCl两种气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。(1)、实验室合成SOCl2的原理之一为SO2+Cl2+SCl2 2SOCl2 , 部分装置(夹持、加热装置略去)如图所示。

①实验室用亚硫酸钠固体与70%硫酸制备SO2 , 不用稀硫酸的原因为。
②装置A、C除干燥气体外,另一作用是;装置D的作用为。
③仪器b的名称为;写出装置 E中发生反应的化学方程式:。
④仪器a中的试剂为。
(2)、甲同学设计实验利用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3。①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为。
②实验室常用过量NaOH溶液吸收SOCl2 , 写出反应的离子方程式:。
9. 硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如图所示。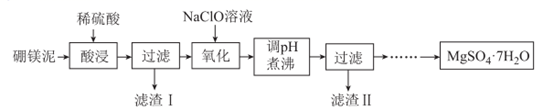
回答下列问题:
(1)、硼与浓的氢氧化钠溶液在加热条件下有类似硅的反应,反应后硼元素以BO 形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:。(2)、Na2B4O7易溶于水,较易发生水解:B4O +7H2O⇌4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有、(填化学式)。(3)、“氧化”过程中发生反应的离子方程式为。(4)、工艺流程中“调pH”应不低于。(已知:常温下,Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Al(OH)3]=1.0×10-33;当溶液中离子浓度小于等于1×10-6mol·L-1时认为该离子沉淀完全)。“煮沸”的目的是。(5)、该工艺流程中包含多次过滤操作,实验室中过滤后洗涤沉淀的操作为。(6)、我国科学家研发出以惰性电极材料电解NaBO2的碱性溶液制备NaBH4的方法。阴极产生NaBH4则阳极的电极反应式为。。10. CO、NH3、NO2、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝。回答下列问题:(1)、硝酸厂常用催化还原法处理尾气。CH4在催化条件下可以将NO2还原为N2。已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-890.3kJ·mol-1;
II.N2(g)+2O2(g)=2NO2(g)ΔH2=+67.7kJ·mol-1
则CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(l)ΔH=。
(2)、工业上利用NH3生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)⇌HCN(g)+3H2(g) ΔH>0。①该反应在(填“较高”或“较低”)温度下能自发进行。
②一定温度下,向2L恒容密闭容器中充入2molCH4(g)和2molNH3(g),发生上述反应,10min末达到平衡状态,测得NH3的体积分数为30%。则0~10min内,用HCN的浓度变化表示的平均反应速率为;CH4的平衡转化率为;该温度下,该反应的平衡常数K=(mol/L)2
(3)、在催化剂作用下,CO还原NO2进行汽车尾气处理:2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)ΔH<0。①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量随时间的变化如图1所示。活化能最小的是[填“E(A)”“E(B)”或“E(C)”]。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图2所示。温度高于300℃,处理NO2的量随温度升高而减小的原因为(假设该温度范围内催化效率相同)。
 (4)、煤燃烧产生的SO2可用足量NaOH溶液吸收生成Na2SO3 , Na2SO3溶液中各离子浓度由大到小的顺序为。11. 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,接触法制硫酸的生产原理分三步。
(4)、煤燃烧产生的SO2可用足量NaOH溶液吸收生成Na2SO3 , Na2SO3溶液中各离子浓度由大到小的顺序为。11. 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,接触法制硫酸的生产原理分三步。I.4FeS2+11O2 2Fe2O3+8SO2;
II.2SO2+O2 2SO3;
III.SO3+H2O=H2SO4。
回答下列问题:
(1)、①基态O原子的核外电子排布式为;基态Fe原子共有种运动状态不同的电子。②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:;含有12molσ键的K4[Fe(CN)6]的物质的量为mol。
③已知Fe2+半径为61pm,Co2+半径为65pm,则在隔绝空气条件下分别加热FeCO3和CoCO3 , FeCO3受热分解温度(填“低于”或“高于”)CoCO3。
(2)、①H2SO4的酸性强于H2SO3的酸性的原因是。②SO2中S原子的杂化方式为;SO3的立体构型为。第一电离能:SO(填“>”或“<”)。
(3)、FeS2晶体的晶胞结构如图所示。
①FeS2晶体中距离Fe2+最近的Fe2+的数目为。
②FeS2晶体的晶胞参数为anm,密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则FeS2的摩尔质量M=g·mol-1(用含a、ρ、NA的代数式表示)。
12. 柳胺酚是一种常用的利胆药物,以苯和F为原料制备柳胺酚的合成路线如图所示。
已知:


回答下列问题:
(1)、F的化学名称为;E中所含官能团的名称为。(2)、D的结构简式为。(3)、苯→A的反应类型为;A→B所需的试剂和条件分别为。(4)、E+F→柳胺酚的化学方程式为。(5)、写出同时满足下列条件的F的同分异构体的结构简式:。①能与FeCl3溶液发生显色反应。
②能发生银镜反应和水解反应。
③核磁共振氢谱有四组峰。
(6)、参照上述合成路线和信息,以苯和乙酸为原料(无机试剂任选),设计制备乙酰苯胺( )的合成路线:。
)的合成路线:。