四川省雅安市2021年高考化学三模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 化学与生活息息相关,下列说法正确的是( )A、淀粉和纤维素都属于多糖 B、天然药物无毒副作用,可以长期服用 C、SO2有毒,严禁将其添加到任何食品和饮料中 D、废弃的聚乙烯塑料属于白色垃圾,能使溴水褪色2. 下列化合物的分子中,所有原子可能共平面的是( )A、环己烷 B、乙醇 C、丙烯 D、苯乙烯3. 短周期主族元素X、Y、Z位于同一周期,它们的原子最外层电子数之和为11,Y的族序数等于其周期序数,Z的阳离子半径在同周期元素的阳离子中最大。下列说法正确的是( )A、化合物Z2O2是只含离子键的离子化合物 B、工业上制备Y的单质可以电解熔融的YX3 C、最高价氧化物对应水化物的碱性:Z>Y D、常温下,Y和Z的单质均能溶于浓硫酸4. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、2.4g镁在空气中燃烧生成MgO和Mg3N2 , 转移电子数无法计算 B、密闭容器中,2mol SO2和1mol O2催化反应后分子总数大于2NA C、1 mol羟基中含有的电子数为10NA D、标准状况下,22.4LHCl溶于水后溶液中有NA个HCl分子5. 一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )
 A、电池的正极反应为H2O2+2e-=2OH- B、电池放电时,Na+移向b极区 C、温度越高,该电池性能提高越大 D、理论上两极分别产生的OH-和 的物质的量之比为8:16. 下列化学实验操作、现象和结论均正确的是( )
A、电池的正极反应为H2O2+2e-=2OH- B、电池放电时,Na+移向b极区 C、温度越高,该电池性能提高越大 D、理论上两极分别产生的OH-和 的物质的量之比为8:16. 下列化学实验操作、现象和结论均正确的是( )选项
操作
现象
结论
A
将苯与液溴反应产生的气体通入AgNO3溶液中
AgNO3溶液中出现淡黄色沉淀
证明苯与液溴发生了取代反应
B
向Al与Fe2O3反应后的固体产物中先加稀硫酸溶解,再加入几滴KSCN溶液
溶液不变红
无法证明反应后固体产物中是否含有Fe2O3
C
向H2O2溶液中加入几滴FeCl3溶液
溶液中产生气泡
发生的离子反应为:2Fe3++H2O2=O2↑+2Fe2++2H+
D|
向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水
溶液未变蓝
淀粉已完全水解
A、A B、B C、C D、D7. 草酸(H2C2O4)是一种二元弱酸。常温下向草酸溶液中滴加NaOH溶液,混合溶液中lgX[x表示 或 ]随pH的变化如图。下列说法中错误的是( ) A、NaHC2O4溶液呈酸性 B、H2C2O4第二步电离常数数量级是10-5 C、pH=7时,c(Na+)=c( )+2c( ) D、1.22<pH<4.19时,c( )>c( )>c(H2C2O4)
A、NaHC2O4溶液呈酸性 B、H2C2O4第二步电离常数数量级是10-5 C、pH=7时,c(Na+)=c( )+2c( ) D、1.22<pH<4.19时,c( )>c( )>c(H2C2O4)二、非选择题
-
8. 实验室熔融法合成高锰酸钾的反应原理:将软锰矿(主要成分为MnO2)、碱和KClO3(还原产物为KCl)混合强热共熔,即可得到墨绿色的锰酸钾熔体。然后再电解锰酸钾溶液得到高锰酸钾。
[实验I]:KMnO4合成步骤过程如下图所示:

[实验II]:KMnO4纯度测定
称取自制的KMnO4晶体2.000g,配制成250.00mL溶液。取25.00mL0.1000mol/L草酸标准液溶液于锥形瓶中,加入25.00mL1mol/L硫酸,混合均匀后加热到75~85℃,用KMnO4溶液滴定,重复操作3次,平均消耗20.00mLKMnO4溶液。
请根据上述实验回答下列问题
(1)、“容器I”的名称是。加热过程中需要不断搅拌,搅拌仪器名称是。(2)、操作②的名称是。烘干操作中温度不能过高的原因是。(3)、“容器I”中发生反应的化学方程式是。(4)、判断电解可以结束的方法是。(5)、电解操作中总反应的离子方程式是。(6)、滴定操作过程中,KMnO4溶液应装入(填“酸式滴定管”或“碱式滴定管”),其自制KMnO4纯度是。9. 三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3 , 工艺流程如下: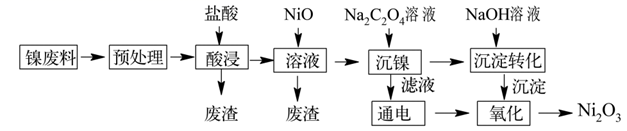
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
氢氧化物
Fe(OH)3
Al(OH)3
Ni(OH)2
Fe(OH)2
开始沉淀时pH
1.8
3.0
7.1
5.8
完全沉淀时pH
3.2
5.0
9.2
8.0
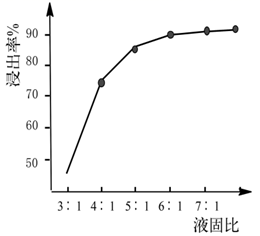
(1)、“预处理”操作选择用酒精清洗的目的是。(2)、“酸浸”时,①温度不宜过高,原因。②常温下,盐酸的浓度为2.5mol·L-1 , “液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为 , 主要的原因是。
 (3)、室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1 , 当溶液的pH调到2时,c(Fe3+)=。加NiO调节pH的范围为。(已知:Ksp[Fe(OH)3]=4.0×10-38)(4)、加入Na2C2O4溶液“沉镍”得到的沉淀为。(5)、电解过程中产生的氯气在碱性条件下生成ClO- , 再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式。10. 在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。(1)、t℃时,关于N2、NH3的两个反应的信息如下表所示:
(3)、室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1 , 当溶液的pH调到2时,c(Fe3+)=。加NiO调节pH的范围为。(已知:Ksp[Fe(OH)3]=4.0×10-38)(4)、加入Na2C2O4溶液“沉镍”得到的沉淀为。(5)、电解过程中产生的氯气在碱性条件下生成ClO- , 再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式。10. 在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。(1)、t℃时,关于N2、NH3的两个反应的信息如下表所示:化学反应
正反应活化能
逆反应活化能
t℃时平衡常数
N2(g)+O2(g)=2NO(g) ∆H>0
akJ∙mol-1
bJ∙mol-1
K1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0
eJ∙mol-1
dJ∙mol-1
K2
请写出t℃时NH3被NO氧化生成无毒气体的热化学方程式(反应热用a、b、e、d代数式表示)。t℃该反应的平衡常数为(用K1和K2表示)。请解释该反应能否自发进行。
(2)、一定温度下,将2molN2和6molH2置于1L的恒容密闭容器中发生如下反应:N2(g)+3H2(g)⇌2NH3(g) △H<0。测得不同条件、不同时间段内合成氨反应中N2的转化率,数据如下:

1小时
2小时
3小时
4小时
T1
30%
50%
80%
80%
T2
35%
60%
a
b
①上表中T1T2(“>”“ <”或“=”表示),其中a、b、80%三者的大小关系是(用含“>”“<”或“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为v= ,k为速率常数。以下说法正确的是(填字母)
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为17且保持不变,则反应达到平衡状态
C.将原容器中的NH3及时分离出来可使v增大
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大。
③已知某温度下该反应达平衡时各物质均为1mol,容器容积为1L,保持温度和压强不变,又充入3molN2后,平衡(填“向左移动”“向右移动”或“不移动”)。
11. 20年11月24日,长征五号遥五运载火箭搭载嫦娥五号月球探测器成功发射升空并将其送入预定轨道,实现了我国首次月球无人采样返回。月球的沙土中含有丰富的钛铁矿,土壤中还含有硅、铝、钾、钡、钴、铷、汞、铜和稀土元素等。(1)、在元素周期表的短周期中,与Al的化学性质最相似的邻族元素是 , Al元素基态原子核外M层电子自旋状态相同的电子数为个。(2)、钠与铝是位于同一周期的金属元素,但NaCl的熔点(801℃)高于AlCl3(194℃),原因是;事实证明熔融态氯化铝可挥发出二聚分子Al2Cl6 , 其结构如图所示,请在图上用“→”标出其配位键;S也是第3周期元素,同周期元素中,第一电离能比S高的有种。 (3)、作为过渡元素的Fe、Cu容易形成配位化合物:如实验室检验Fe3+会用到KSCN溶液,C、N两种元素的电负性大小关系为 , 与SCN-互为等电子体的粒子有(写两种即可)。无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中微粒间不存在的作用力有。
(3)、作为过渡元素的Fe、Cu容易形成配位化合物:如实验室检验Fe3+会用到KSCN溶液,C、N两种元素的电负性大小关系为 , 与SCN-互为等电子体的粒子有(写两种即可)。无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中微粒间不存在的作用力有。A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(4)、钴的一种化合物晶胞结构如下图所示: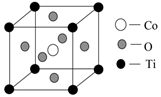
①晶胞中离Ti最近的O有个,其中Co原子位于O原子构成的空隙中。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3 , 则晶胞中Ti与O的最近距离是nm(用含ρ、NA的代数式表示,相对原子质量O-16,Co-59,Ti-48)。
12. 熟地吡喃酮是从中药熟地中提取的有效成分,化合物F是合成熟地吡喃酮的一种中间体,合成路线如图所示。


已知:

回答下列问题:
(1)、F中含氧官能团的名称是。(2)、A→B的反应类型为。(3)、C的核磁共振氢谱有组吸收峰。(4)、D的结构简式是。(5)、E和F同分异构体(填“是”或“不是”)。(6)、化合物 是合成抗菌药磺胺甲唑的一种中间体,写出以乙二酸和丙酮(
是合成抗菌药磺胺甲唑的一种中间体,写出以乙二酸和丙酮(  )为原料合成该化合物的路线图(其他无机及有机试剂任选)。
)为原料合成该化合物的路线图(其他无机及有机试剂任选)。