四川省凉山州2021年高考化学三模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 化学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )A、碳酸钠可用于制作糕点的膨松剂,是因为加热能分解出二氧化碳 B、电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法 C、含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O D、高纯铝被大量用于制造火箭、导弹和飞机的外壳2. 米酵菌酸是变质淀粉类制品引起中毒的主要原因。米酵菌酸分子结构如图所示,下列关于米酵菌酸的说法错误的是( )
 A、分子式为C28H38O7 B、能发生加成反应、取代反应、氧化反应、加聚反应 C、该分子中所有原子可能共平面 D、1 mol米酵菌酸与足量氢气发生反应,最多消耗7mol H23. NA为阿伏加德罗常数的值,则下列叙述正确的是( )A、1 mol
A、分子式为C28H38O7 B、能发生加成反应、取代反应、氧化反应、加聚反应 C、该分子中所有原子可能共平面 D、1 mol米酵菌酸与足量氢气发生反应,最多消耗7mol H23. NA为阿伏加德罗常数的值,则下列叙述正确的是( )A、1 mol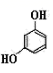 中位于同一平面的原子数目最多为14 NA
B、巯基(-SH)的电子式为
中位于同一平面的原子数目最多为14 NA
B、巯基(-SH)的电子式为 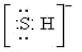 C、N2H4的结构式:
C、N2H4的结构式:  D、常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
4. 二氧化硫是我国工业大气主要污染物之一,但在严格遵守国家有关标准时,在食品生产中也经常使用,某学习小组设计了如图装置用于制取SO2并验证其性质。下列有关说法中正确的是( )
D、常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
4. 二氧化硫是我国工业大气主要污染物之一,但在严格遵守国家有关标准时,在食品生产中也经常使用,某学习小组设计了如图装置用于制取SO2并验证其性质。下列有关说法中正确的是( )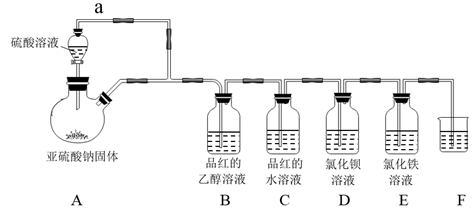 A、装置中连接管a完全多余,可以去掉 B、B装置中未见品红褪色是因为该装置不能制得SO2 C、D装置中不会出现大量白色沉淀 D、E装置中SO2过量时的离子反应方程式为:2Fe3++SO2+8OH-=2Fe(OH)2↓+SO +2H2O5. 短周期主族元素A、B、C、D原子序数依次增大,A、B的简单离子具有相同的电子层结构, B的原子半径是短周期主族元素原子中最大的,C的原子序数是A的2倍,D与B形成的离子化合物的水溶液呈中性。下列说法一定正确的是( )A、A与C在周期表中位于同一主族 B、氢元素与A能形成的化合物不止一种 C、B的简单离子的半径比A的大 D、C最高价氧化物对应水化物一定是一种强酸6. Al-H2O2 电池是一种新型电池,已知H2O2是一种弱酸,在强碱性溶液中以HO 形式存在。现以Al-H2O2为电源(如甲池所示,电池总反应为2Al+3HO =2AlO +OH-+H2O),电解处理有机质废水(如乙池所示)。下列说法正确的是( )
A、装置中连接管a完全多余,可以去掉 B、B装置中未见品红褪色是因为该装置不能制得SO2 C、D装置中不会出现大量白色沉淀 D、E装置中SO2过量时的离子反应方程式为:2Fe3++SO2+8OH-=2Fe(OH)2↓+SO +2H2O5. 短周期主族元素A、B、C、D原子序数依次增大,A、B的简单离子具有相同的电子层结构, B的原子半径是短周期主族元素原子中最大的,C的原子序数是A的2倍,D与B形成的离子化合物的水溶液呈中性。下列说法一定正确的是( )A、A与C在周期表中位于同一主族 B、氢元素与A能形成的化合物不止一种 C、B的简单离子的半径比A的大 D、C最高价氧化物对应水化物一定是一种强酸6. Al-H2O2 电池是一种新型电池,已知H2O2是一种弱酸,在强碱性溶液中以HO 形式存在。现以Al-H2O2为电源(如甲池所示,电池总反应为2Al+3HO =2AlO +OH-+H2O),电解处理有机质废水(如乙池所示)。下列说法正确的是( ) A、电池工作时,甲池、乙池用导线连接的顺序为a连c,b连d B、电池工作一段时间后甲池中pH值减小 C、乙池工作时,质子将从B电极室移向A电极室 D、若B电极上转化1.5molCO2 , 则甲池中溶解4molAl7. Na2S2O5(焦亚硫酸钠)具有较强的还原性,25℃时,将0.5molNa2S2O5溶于水配成IL溶液,溶液中部分微粒浓度随溶液酸碱性变化如图所示。已知:Ksp(BaSO4)=1.0×10-10 , Ksp(BaSO3)=5.0×10-7。下列说法正确的是( )
A、电池工作时,甲池、乙池用导线连接的顺序为a连c,b连d B、电池工作一段时间后甲池中pH值减小 C、乙池工作时,质子将从B电极室移向A电极室 D、若B电极上转化1.5molCO2 , 则甲池中溶解4molAl7. Na2S2O5(焦亚硫酸钠)具有较强的还原性,25℃时,将0.5molNa2S2O5溶于水配成IL溶液,溶液中部分微粒浓度随溶液酸碱性变化如图所示。已知:Ksp(BaSO4)=1.0×10-10 , Ksp(BaSO3)=5.0×10-7。下列说法正确的是( ) A、Na2S2O5水溶液pH=4.5是因为S2O 水解所致 B、由图像可知,25℃时,HSO 的水解平衡常数约为10-7 C、向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO )+2c(SO )+c(OH-) D、将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO 沉淀完全[c(SO )≤1.0×10-5mol·L-1],此时溶液中c(SO )≤0.05mol·L-1
A、Na2S2O5水溶液pH=4.5是因为S2O 水解所致 B、由图像可知,25℃时,HSO 的水解平衡常数约为10-7 C、向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO )+2c(SO )+c(OH-) D、将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO 沉淀完全[c(SO )≤1.0×10-5mol·L-1],此时溶液中c(SO )≤0.05mol·L-1二、非选择题
-
8. 二氯化一氯五氨合钴(III),化学式为[Co(NH3)5Cl]Cl2 , 常温下为紫红色固体,某化学实验小组设计合成了该物质,并对其组成进行了分析:(1)、I.合成:将适量NH4Cl溶于浓氨水,分多次加入研细的CoCl2·6H2O,生成黄红色的沉淀[Co(NH3)6]Cl2 , 不断搅拌下缓慢滴加30%的H2O2和过量浓盐酸(以上操作在通风橱内进行),产生深红色的沉淀[Co(NH3)5H2O]Cl3 , 将混合物放在约85℃的水浴上加热约20min,冷却至室温后过滤,冰水洗涤后烘干,最后得到紫红色固体。
写出黄红色沉淀转化为深红色沉淀的化学方程式。
(2)、已知合成过程中存在[Co(NH3)5H2O]3++Cl-⇌[Co(NH3)5Cl]2++H2O的转化反应(该反应吸热),为探究盐酸用量与反应温度对该合成产率的影响,该小组运用控制变量法分别设计了对照试验,所得数据如下表所示:序号
盐酸浓度/mol·L-1
产量/g
产率/%
序号
反应温度/℃
产量/g
产率/%
1
12.0
3.85
81.3
1
75.0
3.02
63.8
2
6.0
2.99
63.4
2
80.0
3.08
65.0
3
4.0
2.82
59.7
3
85.0
3.33
70.2
4
2.0
2.25
47.6
4
90.0
3.11
65.6
5
1.0
2.04
43.0
5
95.0
2.91
61.5
①从平衡移动的角度分析盐酸浓度对于产率的影响。
②通过表格数据可知温度控制在左右较为适宜,原因是。
(3)、洗涤沉淀所用的玻璃仪器除烧杯外还有 , 检验沉淀是否洗净所需要的试剂为。(4)、II.测定NH3组成。称取0.3g试样溶解于锥形瓶中,再加入浓NaOH溶液并加热,将产生的氨气全部通入30.00mL0.5mol/LHCl标准溶液充分吸收后,以酚酞为指示剂,用0.5mol/LNaOH标准溶液滴定剩余的HCl,共用去标准溶液19.00mL。滴定终点的现象为。
(5)、计算样品中NH3的质量分数为%(保留一位小数)。9. LiNiO2是目前在锂离子电池中得到较广泛应用的一种正极材料,因其价格较为昂贵,故回收再用意义十分重大。一种以共沉淀法从废旧电池中回收并制备超细LiNiO2的工业流程如下图所示:
回答下列问题:
(1)、正极材料粉碎的目的是。(2)、DMF溶液无法溶解的铝单质可以用浓NaOH溶液溶解后再回收利用,写出溶解铝反应的离子反应方程式。(3)、除C的方法可以是加入浓硝酸与过氧化氢的混合溶液,控制温度95℃,此时C与浓硝酸发生反应的化学方程式是;也可以常温加入稀硫酸与过氧化氢的混合溶液,将LiNiO2变为镍锂溶液然后通过(填分离方法除去C,与前者相比,通过比较反应产物来说明后者主要优点为.;试回答能否以盐酸代替硫酸并说明理由(回答“能”或“不能”并简要说明原因)。(4)、高温煅烧得到1mol超细LiNiO2所转移的电子数目为。10. 尿素是氮肥中含氮量最高的品种,是良好的中性速效肥料,且不会影响土质。由氨和二氧化碳合成尿素的总反应式为:2NH3(g)+CO(g)⇌CO(NH2)2(l)+H2O(g) ΔH=-103.7kJ/mol。回答下列问题:(1)、关于合成尿素的反应机理有多种说法,一般认为该反应是分两步进行的:a.2NH3(g)+CO2(g)⇌NH2COONH4(1) ΔH1=-119.2k.J/mol
b.NH2COONH4(l)⇌CO(NH2)2(l)+H2O(g) ΔH2
①ΔH2=。
②已知反应b的活化能远大于反应a的,则该反应机理下的决速步骤是反应(填“a”或“b”)。
③如图为某工厂的尿素合成塔内的轴向温度测定数据,根据图示数据可以推断,合成塔下部1/3的容积内都在进行反应(填“a”或“b”)。
 (2)、反应物料氨与二氧化碳的物质的量比称为氨碳比(下文中水碳比同理),氨碳比对尿素平衡产率的影响如下表所示(恒压20MPa下测定)
(2)、反应物料氨与二氧化碳的物质的量比称为氨碳比(下文中水碳比同理),氨碳比对尿素平衡产率的影响如下表所示(恒压20MPa下测定)温度/℃
NH3:CO2物质的量之比
2
3
4
5
140
43
55
62
73
150
45
58
67
78
160
46
61
70
80
180
49
62
71
81
由表可见,氨碳比提高,尿素的平衡产率也提高,因为过剩的氨气既可以促进二氧化碳的转化,又能够 , 皆可使平衡向着生成尿素的方向移动。
(3)、如图为尿素平衡产率与温度和水碳比的关系,则图中水碳比A、B、C由大到小的关系为。由图可见,相同水碳比时平衡产率开始随温度升高而增大,若继续升温,平衡产率会逐渐下降,试结合分步的反应机理说明其中的原因。 (4)、实验室模拟尿素的合成,恒定温度为160℃,在一容积可变的容器中,按照氨碳比为5充入原料气,恒定压强为20MPa进行反应直到平衡。
(4)、实验室模拟尿素的合成,恒定温度为160℃,在一容积可变的容器中,按照氨碳比为5充入原料气,恒定压强为20MPa进行反应直到平衡。①以下叙述能说明反应达到平衡状态的是
a.容器中氨碳比保持不变
b.气体密度保持不变
c.气体平均相对分子质量保持不变
②计算该温度下的压强平衡常数Kp=MPa-2(以分压表示,分压=总压×气体物质的量分数,结果保留三位小数)。
11.(1)、SnCl2是一种极易水解的氯化物,写出Sn的价电子排布式。配制该溶液时加入浓盐酸能抑制其水解,溶液中存在SnCl ,解释该离子的形成原因。(2)、碳、氮、氧三种元素的第一电离能由小到大的顺序为(用元素符号及“<”表示),H2O、NH3、CH4的键角由小到大的顺序为。(3)、BeCl2是共价分子,其单体可以形成二聚体分子,则形成过程中中心原子的杂化方式由转变为。(4)、羧酸分子(RCOOH)也可以多聚形成链状或环状结构(不发生化学反应),原因是。(5)、已知铜的一种常见氧化物晶胞如图所示
则该氧化物的化学式为。若rCu , =anm,ro=bnm,晶体密度为6.00g/cm3 , 计算该晶胞的空间利用率(列出计算式)。
12. Dofetilide是一种抗心律失常药物,自2000年上市以来,其合成一直备受重视。在已报道的合成路线中,大多是经过化合物A进一步转化得来的。
文献报道的一条合成化合物A的路线如下:

回答下列问题:
(1)、写出反应①的化学方程式。(2)、化合物B含有的官能团名称是。(3)、写出反应物a的结构简式 , 该反应属于(填反应类型)。(4)、NaBH4的作用是。(5)、分子结构中含有苯环,且与化合物C所含官能团相同的同分异构体共有种(不包含C)。(6)、试根据路线提供的反应信息,仅以乙烯为有机试剂原料(无机试剂任选),设计丙酸乙酯的合成路线(简要表明反应试剂及主要产物)。