四川省广元市2021年高考化学三模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 中华传统文化与化学紧密相关,下列有关说法正确的是( )A、“自古书契多编以竹简,其用缣帛(丝织品)者谓之为纸”,纸的主要成分为蛋白质 B、李白有诗云“日照香炉生紫烟”,这是描写碘的升华 C、“司南之杓(勺),投之于地,其柢(勺柄)指南”中的“杓”含磁性物质Fe2O3 D、柴窑烧制出的“明如镜,薄如纸,声如馨”的瓷器,其主要原料为二氧化硅2. 有机物合成对于人类的健康、丰富人类的物质生活和社会经济的发展有着十分重要的作用。某有机物的结构简式如图。下列说法正确的是( )
 A、能与NaHCO3溶液反应 B、1mol该有机物最多能与3molH2反应 C、能发生消去反应生成碳碳双键 D、不能使溴水褪色3. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1mol乙醇分子中含C—H键的数目为6NA B、标准状况下,22.4L的12C18O中含有中子的数目为16NA C、密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加了2NA个P—Cl键 D、常温下,1L0.1mol·L-1的醋酸溶液中H+数目为0.1NA4. 对下列反应的推断或解释正确的是( )
A、能与NaHCO3溶液反应 B、1mol该有机物最多能与3molH2反应 C、能发生消去反应生成碳碳双键 D、不能使溴水褪色3. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1mol乙醇分子中含C—H键的数目为6NA B、标准状况下,22.4L的12C18O中含有中子的数目为16NA C、密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加了2NA个P—Cl键 D、常温下,1L0.1mol·L-1的醋酸溶液中H+数目为0.1NA4. 对下列反应的推断或解释正确的是( )操作
实验现象
推断或解释
A
将少量饱和硼酸溶液滴加到碳酸钠溶液中
无气泡
酸性:H2CO3>H3BO3
B
将C2H4通入溴的四氯化碳溶液中
溴的四氯化碳溶液褪色
C2H4与溴发生了加成反应
C
同温同压下用pH试纸测定相同浓度的碳酸钠和乙酸铵溶液的酸碱性
碳酸钠溶液显碱性,乙酸铵溶液显中性
碳酸钠溶液发生了水解,乙酸铵溶液没有水解
D
向均盛有2mL5%H2O2溶液的两支试管中分别滴入0.3mol/LFeCl3和0.2mol/LCuCl2溶液各1mL
前者生成气泡的速率更快
催化效果:Fe3+>Cu2+
A、A B、B C、C D、D5. X、Y、Z、W、M为短周期主族元素,25℃时,其最高价氧化物对应水化物的溶液浓度均为0.01mol·L-1的pH和原子半径大小的关系如下图所示。下列有关说法错误的是( ) A、M元素一定位于第三周期第IA族 B、X与Z的简单气态氢化物反应生成的化合物中含有离子键和极性键 C、Z、W的气态氢化物的热稳定性:Z<W D、W的氧化物可能具有还原性、氧化性6. HCOOH燃料电池的装置如图所示,M、N表示电极,两电极区间用允许K+、H+通过的半透膜隔开。下列说法正确的是( )
A、M元素一定位于第三周期第IA族 B、X与Z的简单气态氢化物反应生成的化合物中含有离子键和极性键 C、Z、W的气态氢化物的热稳定性:Z<W D、W的氧化物可能具有还原性、氧化性6. HCOOH燃料电池的装置如图所示,M、N表示电极,两电极区间用允许K+、H+通过的半透膜隔开。下列说法正确的是( )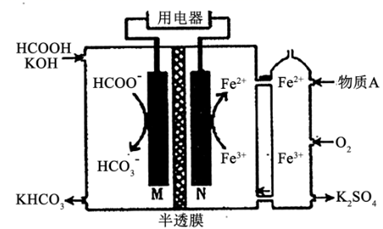 A、M电极反应式为:HCOO-+2OH--2e-=HCO +H2O B、在电池工作时,每生成1molHCO ,将会有1molK+通过半透膜移向右侧 C、图中所示需要补充的A物质为KOH D、电子的流动方向为:N→用电器→M7. 常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
A、M电极反应式为:HCOO-+2OH--2e-=HCO +H2O B、在电池工作时,每生成1molHCO ,将会有1molK+通过半透膜移向右侧 C、图中所示需要补充的A物质为KOH D、电子的流动方向为:N→用电器→M7. 常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( ) A、曲线①代表φ(NH ),曲线②代表φ(NH3·H2O) B、a点溶液中存在c(Cl-)>c(NH )=c(NH3·H2O) C、NH3·H2O的电离常数的数量级为10-4 D、应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
A、曲线①代表φ(NH ),曲线②代表φ(NH3·H2O) B、a点溶液中存在c(Cl-)>c(NH )=c(NH3·H2O) C、NH3·H2O的电离常数的数量级为10-4 D、应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色二、非选择题
-
8. 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(已知:NO+NO2+2NaOH=2NaNO2+H2O):
 (1)、用图甲中装置制备纯净干燥的原料气,补充表中所缺少的药品。
(1)、用图甲中装置制备纯净干燥的原料气,补充表中所缺少的药品。装置I
装置II
烧瓶中
分液漏斗中
制备纯净Cl2
MnO2
浓盐酸
制备纯净NO
Cu
稀硝酸
水
(2)、将制得的NO和Cl2通入图乙对应装置制备NOCl。①装置连接顺序为a→(按气流自左向右方向,用小写字母表示)。
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是。
(3)、有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置。 (4)、装置VIII吸收尾气时,NOCl发生反应的化学方程式为。(5)、有人认为装置VIII中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置VIII氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:。(6)、制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6375g样品溶于50.00mLNaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀Ag2CrO4 , 消耗AgNO3溶液50.00mL。(已知常温下,Ksp(AgCl)=1.8×10-10 , Ksp(Ag2CrO4)=2×10-12)
(4)、装置VIII吸收尾气时,NOCl发生反应的化学方程式为。(5)、有人认为装置VIII中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置VIII氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:。(6)、制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6375g样品溶于50.00mLNaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀Ag2CrO4 , 消耗AgNO3溶液50.00mL。(已知常温下,Ksp(AgCl)=1.8×10-10 , Ksp(Ag2CrO4)=2×10-12)①样品的纯度为%(保留三位有效数字)
②若在滴定终点时测得溶液中CrO 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是。
9. 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为ZnO,并含少量的CuO、MnO2、Fe2O3等)为原料制备氧化锌的工艺流程如图: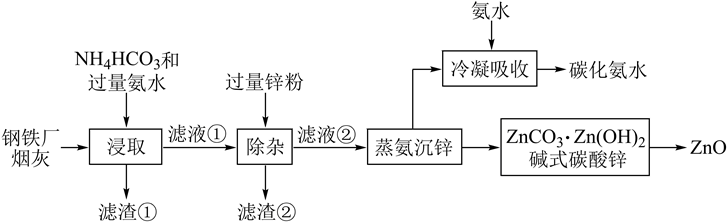 回答下列问题:(1)、“浸取”工序中ZnO、CuO分别转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+配离子,ZnO转化反应的离子方程式为。(2)、将滤渣①用H2SO4溶液处理后得到溶液和固体(均填化学式)。(3)、“除杂”工序中,反应的离子方程式为。(4)、滤渣②的主要成分有(填化学式),回收后可用作冶金原料。(5)、“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,蒸出物冷凝吸收后得到的碳化氨水可返回工序循环使用。(6)、从碱式碳酸锌得到氧化锌的工序名称为。10. 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。(1)、NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
回答下列问题:(1)、“浸取”工序中ZnO、CuO分别转化为[Zn(NH3)4]2+、[Cu(NH3)4]2+配离子,ZnO转化反应的离子方程式为。(2)、将滤渣①用H2SO4溶液处理后得到溶液和固体(均填化学式)。(3)、“除杂”工序中,反应的离子方程式为。(4)、滤渣②的主要成分有(填化学式),回收后可用作冶金原料。(5)、“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,蒸出物冷凝吸收后得到的碳化氨水可返回工序循环使用。(6)、从碱式碳酸锌得到氧化锌的工序名称为。10. 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。(1)、NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
请回答下列问题:
①写出反应II的热化学方程式。
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是(填“反应I”或“反应II”),请写出判断的理由。
(2)、用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:浓度(mol·L-1)
时间(min)
NO
CO2
N2
0
0.200
0
0
12
0.050
0.075
0.075
15
0.100
0.050
0.450
①T℃时,该反应的平衡常数为。
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是。
③在15min时,保持温度和容器体积不变再充入NO和N2 , 使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正v逆(填“>”、“<”或“=”)。
(3)、NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=(用k1、k2表示);图中标出的点O、A、B、C、D中,能表示反应达到平衡状态的点是。 11. VA族元素及其化合物在生产生活中用途广泛。(1)、①P4S3常用于制造火柴,P和S的第一电离能较小的是。
11. VA族元素及其化合物在生产生活中用途广泛。(1)、①P4S3常用于制造火柴,P和S的第一电离能较小的是。②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar] , 有个未成对电子。
(2)、NH3、PH3、AsH3的沸点由高到低的顺序为 , 键角由大到小的顺序为。已知NF3与NH3的立体构型均是三角锥形,向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ , 但NF3不易与Cu2+形成配离子,其原因是。(3)、①白磷在氯气中燃烧可以得到PCl3和PCl5 , 其中气态PCl3分子的立体构型为。②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br- , 分析PCl5和PBr5结构存在差异的原因是。
(4)、锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为。
②晶体的密度为g·cm-3(设NA为阿伏加德罗常数的值)。
12. 某化合物H的合成路线如图所示。 已知:①A为芳香族化合物
已知:①A为芳香族化合物②CH2=CH2+CH≡CH

③R1CHO+R2CH2CHO
 (1)、A中的官能团的名称为 , 物质B的名称为 , 写出B+C→D的反应方程式。(2)、写出F→G的反应类型 , 写出X的结构简式。(3)、写出由F→G的第①步反应的条件是。(4)、G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,写出一种符合下列条件的物质的结构简式。
(1)、A中的官能团的名称为 , 物质B的名称为 , 写出B+C→D的反应方程式。(2)、写出F→G的反应类型 , 写出X的结构简式。(3)、写出由F→G的第①步反应的条件是。(4)、G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,写出一种符合下列条件的物质的结构简式。①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2
②有4种不同化学环境的氢,且原子个数比为6:2:1:1
③苯环上的一元代物只有一种结构
(5)、写出以丙烯为原料合成化合物 的路线流程图(无机试剂任用,流程图形式见题干)。
的路线流程图(无机试剂任用,流程图形式见题干)。