四川省德阳市2021年高考化学二模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 中国传统文化博大精深,也蕴含着许多化学知识。下列说法正确的是( )
A
宋代烧制出“明如镜、声如磬”的瓷器
瓷器主要原料是SiO2
B
《梦溪笔谈》中“方家以磁石磨针锋,则能指南”
磁石主要成分是Fe2O3
C
古代四大发明之一的火药“乃焰硝、硫磺、杉木炭所合”
焰硝是指HNO3
D
《本草纲目》中记载石碱条:“彼人采蒿蓼之属,晒干烧灰,以水淋汁,……浣衣发面,亦去垢发面”
石碱条主要成分是K2CO3
A、A B、B C、C D、D2. 具有独特的物理性能的环状聚合物M的结构简式如图,有关该聚合物的说法错误的是( ) A、每个分子含氮原子数为3+n B、能使酸性高锰酸钾溶液褪色 C、能与乙酸发生酯化反应 D、易溶于有机溶剂的纯净物3. NA是阿伏加德罗常数的值,下列说法正确的是( )A、20gD216O含中子数目为9NA B、1molN2H4含极性键数目为4NA C、50mL2mol/LCH3COONa溶液中,阴离子的数目小于0.1NA D、2.24LCl2与足量NaOH溶液反应,转移电子的数目为0.2NA4. 下列实验方案中,能实现实验目的的是( )
A、每个分子含氮原子数为3+n B、能使酸性高锰酸钾溶液褪色 C、能与乙酸发生酯化反应 D、易溶于有机溶剂的纯净物3. NA是阿伏加德罗常数的值,下列说法正确的是( )A、20gD216O含中子数目为9NA B、1molN2H4含极性键数目为4NA C、50mL2mol/LCH3COONa溶液中,阴离子的数目小于0.1NA D、2.24LCl2与足量NaOH溶液反应,转移电子的数目为0.2NA4. 下列实验方案中,能实现实验目的的是( )实验目的
实验方案
A
检验露置的Na2SO3是否变质
用盐酸酸化的BaCl2溶液
B
缩短容量瓶干燥的时间
将洗净的容量瓶放在烘箱中烘干
C
测定Na2CO3(含NaCl)样品纯度
取一定质量的样品与足量盐酸反应,用碱石灰吸收产生的气体
D
验证氧化性强弱:Ag+>Fe2+
向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液
A、A B、B C、C D、D5. 对于下列实验,能正确描述其反应的离子方程式是( )A、将少量SO2通入次氯酸钠溶液中:ClO-+SO2+H2O=Cl-+ +2H+ B、向含CaSO4的水垢中滴入饱和Na2CO3溶液:CaSO4(s)+ (aq)⇌ (aq)+CaCO3(s) C、用铁电极电解饱和MgCl2溶液:Mg2++2Cl-+2H2O Mg(OH)2↓+Cl2↑+H2↑ D、向(NH4)2Fe(SO4)2溶液中加入含等物质的量溶质的Ba(OH)2溶液:Ba2++ + +OH-=BaSO4↓+NH3·H2O6. 锌铈液流二次电池,放电工作原理如图所示。下列说法正确的是( ) A、充电时,b极发生还原反应 B、放电时,溶液中离子由b极向a电极方向移动 C、放电时,电池的总离子反应方程式为Zn+2Ce4+=Zn2++2Ce3+ D、充电时,当a极增重3.25g时,通过交换膜的离子为0.05mol7. 一种由短周期主族元素组成的化合物,在厨房里经常用到,其结构如图所示,所含元素W、X、Y、Z的原子序数依次增大,Z的核外电子数等于W、X、Y最外层电子数之和。下列有关叙述正确的是( )
A、充电时,b极发生还原反应 B、放电时,溶液中离子由b极向a电极方向移动 C、放电时,电池的总离子反应方程式为Zn+2Ce4+=Zn2++2Ce3+ D、充电时,当a极增重3.25g时,通过交换膜的离子为0.05mol7. 一种由短周期主族元素组成的化合物,在厨房里经常用到,其结构如图所示,所含元素W、X、Y、Z的原子序数依次增大,Z的核外电子数等于W、X、Y最外层电子数之和。下列有关叙述正确的是( )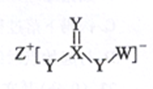 A、非金属性:Y>W>X B、简单离子半径:Z>Y>W C、Z2Y2既能与W2Y反应,也能与XY2反应 D、该化合物中各原子最外层均为8电子结构
A、非金属性:Y>W>X B、简单离子半径:Z>Y>W C、Z2Y2既能与W2Y反应,也能与XY2反应 D、该化合物中各原子最外层均为8电子结构二、非选择题
-
8. 亚硝酰硫酸(NOSO4H)常用于制染料,某学习小组拟在实验室中用下图装置(夹持仪器省略)制备NOSO4H。
已知:①SO2和浓硝酸在浓硫酸存在时反应原理为SO2+HNO3=SO3+HNO2、SO3+HNO2=NOSO4H;浓硝酸受热易分解;
②NOSO4H为棱形结晶,溶于硫酸,遇水易分解;
③2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
回答下列问题:
(1)、I.亚硝酰硫酸的制备
仪器M的名称是 , 导管N的作用是。
(2)、a中药品可选用_______(填标号)。A、亚硫酸钠 B、铜 C、亚硫酸钡 D、蔗糖(3)、控制c中水浴的温度一般不宜高于20℃,其原因是。(4)、为了防止NOSO4H分解,上图中(填“b”“d”或“b和d”)处需连接装置f,e中发生反应的离子方程式为。(5)、II.亚硝酰硫酸纯度的测定称取3.810 g产品放入250 mL的碘量瓶中,并加入100.00 mL0.1500 mol/L KMnO4标准溶液和20 mL20%的稀硫酸,摇匀;用0.6000 mol/LNa2C2O4标准溶液滴定,滴定前读数2.05 mL,滴定终点时读数为22.05 mL。
纯度测定的实验中,下列仪器中不需要用到的是(填标号)。
 (6)、产品的纯度为法的_[M(NOSO4H)=127 g/mol,计算结果保留一位小数]。若未用Na2C2O4标准溶液润洗滴定管会导致测定结果(填“偏高”“偏低”或“无影响”)。9. 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
(6)、产品的纯度为法的_[M(NOSO4H)=127 g/mol,计算结果保留一位小数]。若未用Na2C2O4标准溶液润洗滴定管会导致测定结果(填“偏高”“偏低”或“无影响”)。9. 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子
VO2+
Fe3+
Fe2+
开始沉淀时(c=0.01mo/L)的pH
3.0
2.2
7.5
沉淀完全时(c=1.0×10-5mol/L)的pH
7.0
3.2
9.0
回答下列问题:
(1)、“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是。V2O5被还原的离子方程式为。(2)、常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH7(填“>”“<”或“=”)。(3)、结合“碱溶”和“沉钒”可知, 、 中的氧化性更强,“沉钒”时发生反应的化学方程式为。(4)、利用上述表格数据,计算Fe(OH)2的Ksp=。(5)、某工厂用该工艺流程生产YVO4 , 当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4 , 则整个流程中V的损耗率为。10. H2S广泛存在于废水及天然气等燃气中,除去H2S和回收硫资源是利国利民之举。回答下列问题:(1)、已知:H2(g)+Cl2(g)=2HCl(g) ΔH1H2(g)+S(s)=H2S(g) ΔH2
HCl(g)=HCl(aq) ΔH3
H2S(g)=H2S(aq) ΔH4
用氯气除去废水中H2S的热化学方程式为(反应热用ΔH1、ΔH2、ΔH3和ΔH4表示)。
(2)、H2S可用于高效制取氢气,发生反应为2H2S(g)⇌2H2(g)+S2(g) ΔH容器编号
起始物质的量/mol
H2S
H2
S2
I
0.1
0
0
II
0.1
0
0
III
0.06
0.06
0.04
在三个恒容密闭容器中充入H2S(如上表),容器I、II中H2S的平衡转化率如图所示:

①该反应的∆H0(填“>”或“<”)。
②图中A、B两点中容器内密度较大的是(填“A”或“B”)。
③在T1℃,容器II的体积为6L,该反应20s后达到平衡,则0~20s内容器II中生成S2(g)的反应速率为mol·L-1·min-1;在T1℃,容器III的体积为1L,该反应起始反应速率:v正(H2S)v逆(H2S)(填“>”“<”或“=”)。
(3)、现改变条件进行(2)中反应:开始时,将1molH2S与8molNe(g)混合于恒压(总压为pkPa)密闭容器中反应,测得平衡时各气体[Ne(g)除外]的体积分数随温度变化如图所示。
①当H2S的平衡转化率为α,则S2(g)的平衡分压为。
②在T2℃,该反应的平衡常数KpkPa(Kp为以分压表示的平衡常数,分压=总压×体积分数)。
(4)、H2S燃料电池应用前景非常广阔,该电池示意图如下。
①电极b是极(填“正”或“负”)。
②电极a的反应式为。
11. 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、钛、钙等元素。回答下列问题:(1)、基态Ti原子的价层电子排布式为。根据规则可知硅、硼元素一些化学性质相似。(2)、NaBH4所含元素中第一电离能最小的是(填元素符号)。 与NH3的VSEPR模型相似, 的键角大于NH3的键角的原因是 , 任意写出一种 的等电子体(写粒子符号)。(3)、硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为。 (4)、硼砂的构成为Na2[B4O5(OH)4]·8H2O,其阴离子[B4O5(OH)4]2-的结构如图2所示。B的杂化方式为。硼砂中不存在(填标号)。
(4)、硼砂的构成为Na2[B4O5(OH)4]·8H2O,其阴离子[B4O5(OH)4]2-的结构如图2所示。B的杂化方式为。硼砂中不存在(填标号)。A.氢键 B.金属键 C.配位键 D.离子键
(5)、钙钛矿晶体的结构如图3所示。假设把氧离子看作硬球接触模型,钛离子位于氧离子形成的正八面体中心,钙离子位于立方晶胞的体心。一个钙离子被个氧离子包围。若钛离子与钙离子间最短距离为apm,则氧离子半径为pm。 12. 化合物H是生产某药物的一种重要中间体,H的合成路线如下:
12. 化合物H是生产某药物的一种重要中间体,H的合成路线如下:
回答下列问题:
(1)、A的分子式为。C的官能团名称是。(2)、D的结构简式为。E→F的反应类型为。(3)、写出G→H的化学方程式。(4)、B的一种同分异构体为 ,该分子中手性碳(注:连有四个不同的原子或基团的碳)的个数为;写出化合物B同时符合下列条件的同分异构体的结构简式(任写2种)。
,该分子中手性碳(注:连有四个不同的原子或基团的碳)的个数为;写出化合物B同时符合下列条件的同分异构体的结构简式(任写2种)。 ①与B含相同官能团峰; ②核磁共振氢谱有3组。
(5)、已知:①R1Cl+R2ONa→R1OR2+NaCl(R1、R2为烃基)②“A……B”的合成路线可按如下三种方案完成(所需试剂任选):
步骤
条件
方案
第一步
第二步
第三步
方案I
方案II
方案III
在苯环上新引入基团的位置,将受到已连接基团的影响,请结合以上方案中的信息分析甲基、羧基的相应规律为。