青海省海东市2021年高考化学一模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 历史文物本身蕴含着许多化学知识,下列说法错误的是( )A、享誉世界的中国丝绸其主要成分为天然纤维,在元素组成上与纤维素完全相同 B、范宽的《溪山行旅图》属于绢本水墨画,其中作画用的墨的主要成分为炭黑 C、中国古代专为皇宫烧制的细料方砖,质地密实,敲之作金石之声,称之“金砖”,属于硅酸盐产品 D、我国古老的马家窑青铜刀属于青铜制品,青铜是一种合金2. 《本草纲目·草部·龙胆》冲记载。龙胆可治疗伤寒发狂四肢疼痛等,龙胆中的活性成分龙胆胆苦的结构简式如图所示,下列有关龙胆苦苷的说法错误的是( )
 A、分子中含有16个碳原子 B、能与金属钠反应 C、能使酸性K2Cr2O7溶液褪色 D、不能与NaOH溶液反应3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、3.2gN2H4与足量O2反应,完全转化为N2时转移的电子数为0.4 NA B、 由氖气与甲烷组成的混合气体中含有的电子总数为0.1 NA C、含 的浓硝酸与足量 充分反应,生成 的数目为0.1 NA D、 与含 的浓盐酸充分反应,生成 的数目为0.1 NA4. 以石墨为电极材料,熔融硝酸钠为电解质,NO2-O2燃料电池的工作原理如图所示。
A、分子中含有16个碳原子 B、能与金属钠反应 C、能使酸性K2Cr2O7溶液褪色 D、不能与NaOH溶液反应3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、3.2gN2H4与足量O2反应,完全转化为N2时转移的电子数为0.4 NA B、 由氖气与甲烷组成的混合气体中含有的电子总数为0.1 NA C、含 的浓硝酸与足量 充分反应,生成 的数目为0.1 NA D、 与含 的浓盐酸充分反应,生成 的数目为0.1 NA4. 以石墨为电极材料,熔融硝酸钠为电解质,NO2-O2燃料电池的工作原理如图所示。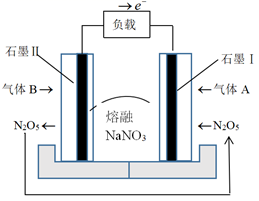
下列关于该燃料电池的说法正确的是( )
A、石墨I电极的电势低于石墨Ⅱ电极的电势 B、石墨Ⅱ电极上消耗的NO2的体积与生成的N2O5的体积之比为2:1 C、该电池工作时,熔融NaNO3中Na+向石墨Ⅱ电极移动 D、该电池的总反应方程式为4NO2+O2=2N2O55. 下列实验操作、现象及结论均正确的是( )选项
实验操作
现象
结论
A
将用稀硫酸酸化后的 溶液滴入 溶液中
溶液变黄
氧化性:
B
将乙醇与浓硫酸的混合溶液加热,产生的气体直接通入酸性 溶液中
溶液紫色逐渐褪去
产生的气体一定是乙烯
C
向 溶液中滴加 溶液
生成蓝色沉淀
的酸性比 的强
D
向两支盛有 溶液的试管中,分别滴加淀粉溶液和 溶液
前者溶液变蓝,后者有黄色沉淀生成
溶液中含有 和
A、A B、B C、C D、D6. 室温下,下列关于电解质的说法中正确的是( )A、中和等体积、等浓度的盐酸和醋酸溶液至pH=7,后者消耗的氢氧化钠的物质的量更多 B、向NaHS溶液中加入适量KOH后: C、将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,若溶液中存在 ,则氨水的电离平衡常数 D、将等浓度、等体积的 溶液和 溶液混合:7. 短周期主族元素X、Y、Z、W的原子序数依次增大,元素Y是地壳中含量最多的元素,X与Z同主族且二者可形成离子化合物,W的最外层电子数是其电子层数的2倍。下列说法正确的是( )A、非金属性:X<Y<W B、原子半径:Y<W<Z C、元素W的含氧酸均为强酸 D、Z的氧化物对应的水化物为弱碱二、非选择题
-
8. 某科学研究小组没计以辉钼矿(MoS2、CuFeS2、Cu2S及SiO2等)为原料制备少量钼酸铵的工艺流程如图:

已知:①“焙砂”中有MoO3、CuSO4、CuMoO4、Fe2O3、Fe2(SO4)3、SiO2。
②"氨浸"时,铜元素转化为[Cu(NH3)4](OH)2(深蓝色),钼元素转化为(NH4)2MoO4。
③[Cu(NH3)4](OH)2 [Cu(NH3)4]2++2OH-。
回答下列问题:
(1)、"焙烧"在马弗炉中进行。①为了使辉钼矿充分培烧,需要采取的措施是 (写出一种)。
②马弗炉中逸出的气体可用溶液吸收。
③MoS2转化成MoO3的化学方程式为。
(2)、"氨浸"时发生多个反应,其中CuMoO4被浸取的化学方程式为。(3)、"滤渣Ⅰ"的成分有SiO2、 (填化学式)。(4)、"沉铜"是在80℃时进行的,铜沉淀完全的依据是 , 发生反应的离子方程式为。9. 丙烯是三大合成材料的基本原料,主要用于生产聚丙烯、丙烯䝼、异丙醇、丙酮和环氧丙烷等,丙烷脱氢作为一条增产丙烯的非化石燃料路线具有极其重要的现实意义。丙婉烷脱氢技术主要为直接催化脱氢和CO2氧化脱氢。(1)、丙烷直接催化脱氢生成丙烯和氢气的反应中,产物的物质的量之比n(C3H6):n(H2)=。(2)、丙烷直接催化脱氢制丙烯的反应为吸热反应,反应中往往伴随副反应的发生(副反应中不生成丙烯和氢气),丙烷和丙烯的平衡体积分数与温度、压强的关系如图所示(图中压强分别的为1×10 4P和1×10 5Pa)。
①1×105 Pa时,图中表示丙烷和丙烯体积分数变化的曲线分别为。
②提高丙烷直接催化脱氢制丙烯的反应平衡转化率的方法有、。
③1×105 Pa,500℃时,该反应的平衡常数Kp= ( 用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)Pa。
(3)、CO2氧化脱氢法,相关的主要反应如下:I.C2H8(g) +CO2(g) C3H6(g)+CO(g)+ H2O(g)
II.C3H8(g)+3CO2(g) 6CO(g)+4H2(g)
CO2和C3H8按物质的量之比1:1投料,在1023 K和保持总压恒定的条件下,研究一定时间内催化剂X对CO2氧化C3H8制C3H6的影响,所得实验数据如下表:
催化剂
C3H8的转化率/%
CO2的转化率/%
C3H6的转化率/%
催化剂X
19.0
38.6
3.3
结合具体反应分析,一定时间内在催化剂X的作用下,CO2氧化C3H8的主要产物是 , 判断的依据是。
10. 叠氮化钠(NaN3)为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用下列装置制取叠氮化钠。
I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20 g、亚硝酸钠40 g、水60 g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35 ℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼(N2H4• H2O、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(C2H5ONO)进入装置B中,控制温度在70-90 ℃内,持续加热40 mino
II.部分药品的性质如下表:
密度/g • cm-3
熔点/°c
沸点/°c
溶解性
乙醇
0.816
-114
7& 4
与水以任意比例互溶,可与醚、氯仿、丙酮混溶
亚硝酸乙酯
0. 90
-93
17.2
不溶于水,可溶于乙醇、乙醚
叠氮化钠
1. 85
275
300
易溶于水和液氨,微溶于乙醇,不溶于乙醚
已知:2C2 H5OH+H2SO4+2NaNO2 2C2 H5ONO↑ +Na2SO4+2H2Oo
回答下列问题:
(1)、连接好装置后,进行的第一步操作是。(2)、对装置B中液体进行加热,合适的加热方式为。(3)、装置A中用恒压漏斗代替分液漏斗的优点是;缓慢滴加硫酸,控制滴入速率的原因是。(4)、装置B中水合腓、亚硝酸乙酯和氢氧化钠在80 ℃时反应生成叠氮化钠、乙醇等物质,该反应的化学方程式为。(5)、产品的分离:将装置B中反应后的混合液倒入蒸馏烧瓶中,加热到80-90 ℃,除去混合物 中的乙醇。将蒸馏后所得母液降温结晶,过滤得到叠氮化钠晶体,再用去离 子水重结晶得NaN3产品。冷凝管中的冷却水要“b进a出”的原因是。 (6)、产品纯度测定:取6.5g产品,加入足量蒸馏水溶解,并加入适量稀硫酸酸化,向混合液中加入20.00mL1mol·L-1KMnO4溶液(l0NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑),反应后溶液呈紫红色。再用0.2mol•L-1的Na2SO3标准液滴定过量的KMnO4溶液,到达滴定终点时消耗标准液25.00mL
(6)、产品纯度测定:取6.5g产品,加入足量蒸馏水溶解,并加入适量稀硫酸酸化,向混合液中加入20.00mL1mol·L-1KMnO4溶液(l0NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑),反应后溶液呈紫红色。再用0.2mol•L-1的Na2SO3标准液滴定过量的KMnO4溶液,到达滴定终点时消耗标准液25.00mL①到达滴定终点时的现象为。
②叠氮化钠的纯度为。
11. 和 都是常见的氧化剂。(1)、 的基态原子的核外电子排布式为 , 的基态原子核外电子有种运动状态。(2)、 是石油化工中重要的催化剂之一,可催化异丙苯裂化生成苯和丙烯。 丙烯分子中含有 键与 键数目之比为 , 丙烯分子中碳原子的杂化轨道类型为。(3)、H、O、 三种元素的电负性按由大到小的顺序为(用元素符号表示)。(4)、 是一种弱酸,其结构式为。(5)、 的氧化物有多种,其中五氧化铬,常温下为蓝色结晶,化学式为 ,也可写成 ,则其中过氧键的数目为。(6)、 的某种氧化物晶体的晶胞结构如图所示,其化学式为.设阿伏加德罗常数的值为 ,则该晶体的密度为 。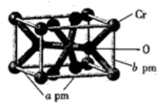 12. 呋虫胺(F)为最新一代超级烟碱类杀虫剂,其结构中用四氢呋喃基取代了氯代吡啶基、氯代噻唑基等,在性能方面也与其他杀虫剂有所不同,杀虫谱更广,被称为“呋喃烟碱”,图为呋虫胺的一种合成路线:
12. 呋虫胺(F)为最新一代超级烟碱类杀虫剂,其结构中用四氢呋喃基取代了氯代吡啶基、氯代噻唑基等,在性能方面也与其他杀虫剂有所不同,杀虫谱更广,被称为“呋喃烟碱”,图为呋虫胺的一种合成路线:
已知:
 +H2O。
+H2O。回答下列问题:
(1)、B中所含官能团的名称为。(2)、反应A→B的反应类型为。(3)、写出C的最简单同系物的名称:。(4)、同一碳原子上连有四种不同原子或原子团时,该碳原子称为手性碳,A、B、C、D、E、F六种物质中含有手性碳原子的是(填标号)。(5)、写出D→E的化学方程式:。(6)、A的同分异构体有多种,其中符合下列条件的同分异构体有种(不考虑立体异构)。①仅含一种官能团 ②与碳酸氢钠反应有气体放出 ③分子中含有两个甲基
写出其中核磁共振氢谱有三组峰且峰面积之比为6∶4∶2的A的同分异构体的结构简式:(任写一种)。
(7)、请写出以ClCOOH、CH3CH2OH和 为原料合成
为原料合成  的合成路线[可选用(CH3)3COH为溶剂,其他无机试剂任选]。
的合成路线[可选用(CH3)3COH为溶剂,其他无机试剂任选]。