宁夏吴忠市2021年高考化学二模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 化学与生产,生活、环境等息息相关,下列说法中错误的是( )A、“用浓酒和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是蒸馏 B、用活性炭为糖浆脱色和用SO2漂白纸浆的原理不相同 C、港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物 D、“玉不琢不成器”、“百炼方能成钢”发生的均为物理变化2. 橙花醇乙酸酯是一种食用香料,为天然橙花、橙叶和柠檬等油的成分,其结构简式如图所示,下列关于该有机物的说法正确的是( )
 A、该有机物的分子式为C12H20O2 B、1 mol该分子可以与2 mol NaOH发生反应 C、分子中所有碳原子不可能共面 D、能使酸性高锰酸钾和溴水褪色,且褪色原理一致3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol SiO2中含有2 mol硅氧键 B、1 mol T2O比1 mol H2O多4 NA个中子 C、1 L 0.1 mol/LNa2CO3溶液中含有的阴离子的总数为0.1 NA D、标准状况下,1 mol O2和O3的混合物中有5NA个氧原子4. 用下列实验装置进行相应实验,能达到实验目的的是( )
A、该有机物的分子式为C12H20O2 B、1 mol该分子可以与2 mol NaOH发生反应 C、分子中所有碳原子不可能共面 D、能使酸性高锰酸钾和溴水褪色,且褪色原理一致3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol SiO2中含有2 mol硅氧键 B、1 mol T2O比1 mol H2O多4 NA个中子 C、1 L 0.1 mol/LNa2CO3溶液中含有的阴离子的总数为0.1 NA D、标准状况下,1 mol O2和O3的混合物中有5NA个氧原子4. 用下列实验装置进行相应实验,能达到实验目的的是( ) A、用装置I过滤海带灰的浸泡液以获得含I-的溶液 B、用装置II蒸干氯化铵饱和溶液制备NH4Cl晶体 C、用装置III收集铜粉与稀硝酸反应产生的NO D、用图IV所示装置控制制取少量纯净的CO2气体5. 据文献报道:Pd-Mg/SiO2催化某反应的一种反应机理如图所示。下列说法错误的是( )
A、用装置I过滤海带灰的浸泡液以获得含I-的溶液 B、用装置II蒸干氯化铵饱和溶液制备NH4Cl晶体 C、用装置III收集铜粉与稀硝酸反应产生的NO D、用图IV所示装置控制制取少量纯净的CO2气体5. 据文献报道:Pd-Mg/SiO2催化某反应的一种反应机理如图所示。下列说法错误的是( ) A、该反应可消耗CO2产生清洁燃料CH4 B、H2在Pd催化剂的表面断裂H-H键 C、该催化循环CO2变成了含镁的化合物 D、使用催化剂可以大大降低该反应的活化能使反应快速进行6. 短周期主族元素W、X、Y、Z的原子序数依次增大,其中元素W的简单氢化物与其最高价氧化物的水化物能发生反应生成一种盐,X元素在短周期中原子半径最大,Y的离子半径在同周期中最小,W和X的最外层电子数之和等于Z原子核外最外层电子数。下列说法正确的是( )A、简单离子半径:Z>Y>W>X B、X、Y、Z三种元素对应的最高价氧化物的水化物可以两两相互反应 C、工业上用电解X、Y对应的熔融氯化物来制取X、Y单质 D、Z的氧化物对应的水化物为强酸7. 向如图所示电池中加入稀H2SO4酸化,若充电时m侧溶液颜色由蓝色变为黄色,则下列叙述正确的是( )
A、该反应可消耗CO2产生清洁燃料CH4 B、H2在Pd催化剂的表面断裂H-H键 C、该催化循环CO2变成了含镁的化合物 D、使用催化剂可以大大降低该反应的活化能使反应快速进行6. 短周期主族元素W、X、Y、Z的原子序数依次增大,其中元素W的简单氢化物与其最高价氧化物的水化物能发生反应生成一种盐,X元素在短周期中原子半径最大,Y的离子半径在同周期中最小,W和X的最外层电子数之和等于Z原子核外最外层电子数。下列说法正确的是( )A、简单离子半径:Z>Y>W>X B、X、Y、Z三种元素对应的最高价氧化物的水化物可以两两相互反应 C、工业上用电解X、Y对应的熔融氯化物来制取X、Y单质 D、Z的氧化物对应的水化物为强酸7. 向如图所示电池中加入稀H2SO4酸化,若充电时m侧溶液颜色由蓝色变为黄色,则下列叙述正确的是( ) A、放电时,装置中n电极做正极 B、充电过程中,m极附近pH增大 C、充电过程中,n极发生的电极反应式为V3++e-=V2+ D、放电时,H+从左槽迁移进入右槽
A、放电时,装置中n电极做正极 B、充电过程中,m极附近pH增大 C、充电过程中,n极发生的电极反应式为V3++e-=V2+ D、放电时,H+从左槽迁移进入右槽二、非选择题
-
8. 硫酸镍(NiSO4)主要用于电镀工业,是电镀镍和化学镍的主要镍盐。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,从该矿渣中回收NiSO4的工艺流程如下:
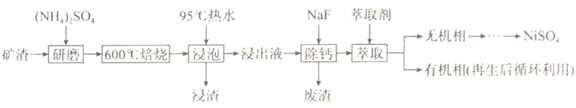 (1)、“焙烧”时发生多个反应,其中NiFe2O4生成NiSO4、Fe2(SO4)3 , 发生该反应的化学方程式为。(2)、“浸泡”时用“95℃热水”的目的是 , “浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为。(3)、“浸渣”的成分除Fe2O3、FeO(OH)外还含有(填化学式),为检验浸出液中是否含有Fe3+ , 可选用的化学试剂是。(4)、“萃取"过程中发生反应Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值为;在(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(1)、“焙烧”时发生多个反应,其中NiFe2O4生成NiSO4、Fe2(SO4)3 , 发生该反应的化学方程式为。(2)、“浸泡”时用“95℃热水”的目的是 , “浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为。(3)、“浸渣”的成分除Fe2O3、FeO(OH)外还含有(填化学式),为检验浸出液中是否含有Fe3+ , 可选用的化学试剂是。(4)、“萃取"过程中发生反应Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值为;在(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 9. 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如图所示。
9. 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如图所示。
有关物质性质如下表
甘氨酸
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇
易溶于水和乙醇
易溶于水,难溶于乙醇
两性化合物
强酸性、强还原性
实验过程:
I.合成:装置C中盛有31.8 g FeCO3和200 mL 2.0 mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
II.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)、装置B盛装的试剂为;仪器b比a的优点是。(2)、若想证明C装置中空气排净,则D中通常盛装的试剂为。(3)、合成过程加入柠檬酸的作用是促进FeCO3溶解和。(4)、加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为。(5)、检验产品中是否含有Fe3+的最佳试剂是。(6)、本实验制得24.5 g甘氨酸亚铁,则其产率是%。10. 近几年经济发展迅速,汽车数量越来越多,在方便我们的工作和生活的同时,也带来了严重的环境问题,为了消除汽车尾气对大气环境和人体健康造成的影响,科学家们想了很多处理尾气的方法。(1)、活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。①判断该反应达到平衡的标志为。(填标号)
A.容器内气体的物质的量恒定 B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2) D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:

a.图中A点v正v逆(填“>”“<”或“=”)。
b.0~20min内的N2平均反应速率v=;在此过程中,气体的平均相对分子质量 (填“增大”、“减小”或“不变”)。
c.第20min时,外界改变的条件可能是。
(2)、CO可以与NO2反应:4CO(g)+2NO2(g) N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图像,根据图像分析:△H0(填“>”或“<”,下同);p1p2。 (3)、在汽车排气管上安装催化转化器可以有效降低汽车尾气中的NO和CO,反应方程式为:2CO(g)+2NO(g) N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=。(Kp为以分压表示的平衡常数,分压=总压×某物质的物质的量分数)11. 氮化镓(GaN)结构与金刚石类似,是一种半导体材料,因其具有良好的电学特性,广泛的应用于电子行业,近年智能手机的快速充电器中就使用了氮化镓材料。(1)、基态N原子的电子排布式为;基态Ga原子核外电子能量最高的电子占据的能级为。(2)、GaN、GaP、GaAs熔点如下表所示,分析其变化原因。
(3)、在汽车排气管上安装催化转化器可以有效降低汽车尾气中的NO和CO,反应方程式为:2CO(g)+2NO(g) N2(g)+2CO2(g),若在密闭的容积不变的容器中进行该反应,起始加入的CO和NO的物质的量之比为3:2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数Kp=。(Kp为以分压表示的平衡常数,分压=总压×某物质的物质的量分数)11. 氮化镓(GaN)结构与金刚石类似,是一种半导体材料,因其具有良好的电学特性,广泛的应用于电子行业,近年智能手机的快速充电器中就使用了氮化镓材料。(1)、基态N原子的电子排布式为;基态Ga原子核外电子能量最高的电子占据的能级为。(2)、GaN、GaP、GaAs熔点如下表所示,分析其变化原因。晶体
GaN
GaP
GaAs
熔点/℃
1700
1480
1238
(3)、GaN可在高温下由金属Ga和NH3反应制取。N原子和H原子可以形成多种微粒,如:NH3、NH 、NH 、N2H4、N2H 、N2H 等。在N2H 中,N原子的杂化方式为。与N2H 互为等电子体的物质是(写出一种);在N2H 中存在的化学键类型有。a.极性键 b.非极性键 c.离子键 d.配位键
(4)、GaN的晶胞结构如图所示:其中与Ga原子最近的N原子所构成的空间结构为;若GaN晶体的密度为6.1 g/cm3 , 阿伏加德罗常数为NA , 则距离最近的两个N原子间的距离为nm(写出表达式即可)。 12. 化合物F是一种环状化合物,其合成路线如下:
12. 化合物F是一种环状化合物,其合成路线如下:
已知:①CH2=CH-CH=CH2+CH2=CH2

②2R-C≡CH R-C≡C-C≡C-R+H2
③R-CHO+R’-CH2CHO
 +H2O
+H2O回答下列问题:
(1)、化合物A的名称是 , B→C的反应类型是。(2)、化合物F的结构简式是 , 含氧的官能团名称是。(3)、B中最多有个原子共线。(4)、写出D→E的化学方程式。(5)、E的同分异构体满足以下条件:①与E具有相同的官能团;
②核磁共振氢谱显示5种不同化学环境的氢。
则E的同分异构体的结构简式为。