海南省海口市2021年高考化学模拟试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 改革开放40年,我国取得了很多世界瞩目的科技成果,下列说法错误的是( )A、蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素 B、中国天眼传输信息用的光导纤维材料是硅单质 C、国产C919用到的氮化硅陶瓷是新型无机非金属材料 D、港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能2. 下列化学用语表达错误的是( )A、乙烯的实验式:CH2 B、氨气的电子式:
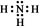 C、次氯酸的结构式:H-Cl-O
D、2-甲基丁烷的键线式:
C、次氯酸的结构式:H-Cl-O
D、2-甲基丁烷的键线式: 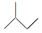 3. 化学在生活中有着广泛的应用,下列说法正确的是( )A、利用溶解度不同,可用水鉴别乙酸和乙酸乙酯 B、根据淀粉的特性,木材纤维和土豆淀粉遇碘水均显蓝色 C、脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 D、蛋白质溶液中加入 (NH4)2SO4、CuSO4溶液均能凝结析出,加水后又能溶解4. 实验室完成下列操作,一般不宜使用锥形瓶的是( )A、实验室制蒸馏水 B、酸碱中和滴定 C、配制一定浓度的H2SO4溶液 D、用高锰酸钾与浓盐酸制Cl25. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1 L 0.1 mol∙L−1 NaClO溶液中含有ClO-的数目为0.1NA B、将1 mol NH3完全溶于水,所得溶液中n(NH3∙H2O)+n(NH )=NA C、1 L 0.1 mol∙L−1 NaHSO4溶液中含有的阳离子数目为0.1NA D、将1 mol CH3COONa溶于稀醋酸中使溶液呈中性,溶液中含CH3COO-数目为NA6. 硫元素的几种化合物存在下列转化关系:
3. 化学在生活中有着广泛的应用,下列说法正确的是( )A、利用溶解度不同,可用水鉴别乙酸和乙酸乙酯 B、根据淀粉的特性,木材纤维和土豆淀粉遇碘水均显蓝色 C、脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 D、蛋白质溶液中加入 (NH4)2SO4、CuSO4溶液均能凝结析出,加水后又能溶解4. 实验室完成下列操作,一般不宜使用锥形瓶的是( )A、实验室制蒸馏水 B、酸碱中和滴定 C、配制一定浓度的H2SO4溶液 D、用高锰酸钾与浓盐酸制Cl25. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1 L 0.1 mol∙L−1 NaClO溶液中含有ClO-的数目为0.1NA B、将1 mol NH3完全溶于水,所得溶液中n(NH3∙H2O)+n(NH )=NA C、1 L 0.1 mol∙L−1 NaHSO4溶液中含有的阳离子数目为0.1NA D、将1 mol CH3COONa溶于稀醋酸中使溶液呈中性,溶液中含CH3COO-数目为NA6. 硫元素的几种化合物存在下列转化关系:浓H2SO4 SO2 Na2SO3溶液 Na2S2O3 S
下列判断错误的是( )
A、反应①中浓硫酸作氧化剂 B、反应②表明SO2有酸性氧化物的性质 C、反应③的原子利用率是100% D、反应④稀H2SO4作还原剂7. 近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法错误的是( ) A、过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键 B、过程②和③吸收了能量并形成了O-H键和C-H键 C、CO2和HCOOH中均只含有极性共价键 D、每1molCO2完全转化为甲酸需得2mole-8. 五种主族元素在周期表中的位置如图所示。L的单质在常温常压下呈液态,且保存时需要用水液封。下列推断正确的是( )
A、过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键 B、过程②和③吸收了能量并形成了O-H键和C-H键 C、CO2和HCOOH中均只含有极性共价键 D、每1molCO2完全转化为甲酸需得2mole-8. 五种主族元素在周期表中的位置如图所示。L的单质在常温常压下呈液态,且保存时需要用水液封。下列推断正确的是( )X
Y
Z
T
L
A、原子半径:X<Y<Z<T<L B、气态氢化物的还原性:L>Z>T C、X的电负性是五种元素中最小的 D、Y和T组成的化合物是离子化合物9. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡: , 。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是( )A、若 ,则该反应达到平衡状态 B、两次平衡时,后一次平衡时 的浓度大 C、重新达到平衡,密闭容器中氨气的体积分数不变 D、若开始时向容器中加入2molNH3和1molCO2 , 则达到平衡时放出akJ热量10. 下列实验设计及其对应的离子方程式均正确的是( )A、过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O C、用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- D、室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+11. 探究铝片与 溶液的反应。

无明显现象
铝片表面产生细小气泡
出现白色浑浊,产生大量气泡(经检验主要为 )
下列说法错误的是( )
A、 溶液中存在水解平衡: B、对比Ⅰ、Ⅲ,说明 溶液能破坏铝表面的保护膜 C、推测出现折色浑浊的可能原因为: D、加热及 逸出对 水解平衡移动方向的影响是相反的二、多选题
-
12. 化合物Y具有抗菌、消炎作用,可由X制得。
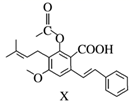
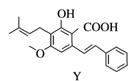
下列有关化合物X、Y的说法正确的是( )
A、1 mol X最多能与3 mol NaOH反应 B、Y与乙醇发生酯化反应可得到X C、X、Y均能与酸性KMnO4溶液反应 D、室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等13. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是( )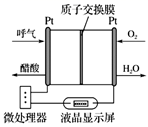 A、电子由O2所在的铂电极流出 B、标况下消耗224 mL O2 , 通过质子交换膜的H+个数为0.04 NA C、电池的负极反应式为CH3CH2OH+3H2O−12e− = 2CO2↑+12H+ D、微处理器通过检测电流大小而计算出被测气体中酒精的含量14. 下列物质的性质变化规律与与键能无关的是( )A、与硅相比,金刚石的硬度大、熔点高 B、HF、HCl、HBr、HI热稳定性依次减弱 C、F2、Cl2、Br2、I2的沸点逐渐升高 D、H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶
A、电子由O2所在的铂电极流出 B、标况下消耗224 mL O2 , 通过质子交换膜的H+个数为0.04 NA C、电池的负极反应式为CH3CH2OH+3H2O−12e− = 2CO2↑+12H+ D、微处理器通过检测电流大小而计算出被测气体中酒精的含量14. 下列物质的性质变化规律与与键能无关的是( )A、与硅相比,金刚石的硬度大、熔点高 B、HF、HCl、HBr、HI热稳定性依次减弱 C、F2、Cl2、Br2、I2的沸点逐渐升高 D、H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶三、非选择题
-
15. 次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
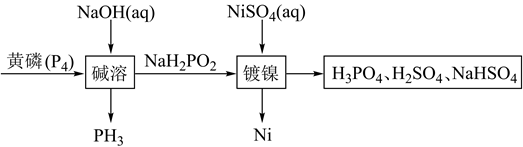
据此回答下列问题:
(1)、红磷与黄磷之间的关系为。(2)、次磷酸钠中磷元素的化合价为。(3)、写出碱溶过程的化学反应方程式 , 该反应中氧化剂与还原剂物质的量之比为。(4)、已知次磷酸钠中的 为四面体结构,请写出 的结构式 , 次磷酸钠NaH2PO2为 填“酸式盐”、“碱式盐”、“正盐”
填“酸式盐”、“碱式盐”、“正盐”  。 (5)、请简述化学镀镍的反应原理。16. 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(1)、Deacon直接氧化法可按下列催化过程进行:
。 (5)、请简述化学镀镍的反应原理。16. 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(1)、Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ∙mol−1
CuCl(s)+ O2(g)=CuO(s)+ Cl2(g) ΔH2=−20 kJ∙mol−1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ∙mol−1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ∙mol−1
(2)、Deacon发明的直接氧化法原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),在刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系如图所示: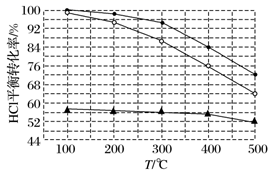
据图像分析可知:反应平衡常数K(300 ℃)K(400 ℃)(填“大于”或“小于”)。
(3)、设HCl初始浓度为c0 , 根据进料浓度比c(HCl)∶c(O2)=1∶1的数据,计算K(400 ℃)=(列出计算式)。(4)、按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是、。在一定温度的条件下,进一步提高HCl的转化率的方法是。(写出2种)17. 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
已知:2NaClO + (CNO)3H3 = (CNO)3Cl2Na + NaOH + H2O
回答下列问题:
(1)、仪器a的名称为恒压滴液漏斗,与分液漏斗相比其优点是。(2)、待装置B中出现现象时,可由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入 Cl2的理由是。(3)、反应结束后,装置B中的浊液经过滤、、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是。(4)、通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。反应原理: [(CNO)3Cl2]-+ H+ +2H2O = (CNO)3H3 + 2HClO, HClO + 2I- + H+ = I2 + Cl-+ H2O, I2 + 2S2O = S4O + 2I-
实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用 c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为 V mL。
①滴定终点现象为。
②该样品的有效氯含量表达式为 。(该样品的有效氯= ×100%)
18. 2−氨−3−氯苯甲酸是白色晶体,是重要的医药中间体,其制备流程如下: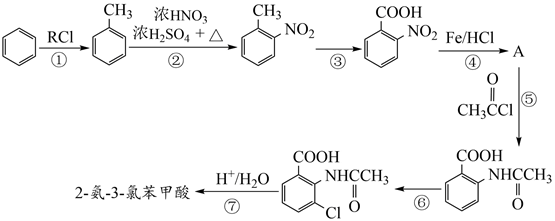
回答下列相关问题
(1)、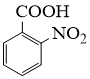 的名称是。反应②的反应类型为。 (2)、为了实现反应③的转化,通常可采用的试剂是。(3)、生成2−氨−3−氯苯甲酸的方程式为。(4)、同时符合下列两个条件的有机物共有种同分异构体。其中仅有3种等效氢的有机物结构简式为。
的名称是。反应②的反应类型为。 (2)、为了实现反应③的转化,通常可采用的试剂是。(3)、生成2−氨−3−氯苯甲酸的方程式为。(4)、同时符合下列两个条件的有机物共有种同分异构体。其中仅有3种等效氢的有机物结构简式为。①相对分子质量比
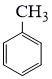 大42的苯的同系物;②与酸性KMnO4反应能生成二元羧酸;(5)、事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
大42的苯的同系物;②与酸性KMnO4反应能生成二元羧酸;(5)、事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。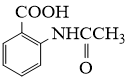
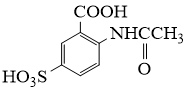
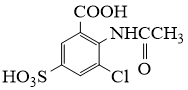
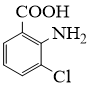
请从步骤⑥产率低的原因进行推测,上述过程能提高产率的原因可能是。若想要进一步提高产率,2−氨−3−氯苯甲酸的合成流程中,可以优化的步骤还有。
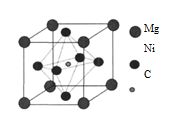
19. 金属Ni可以与Mg、C形成一种化合物M,M是一种新型超导体,它的临界温度为8K。回答下列问题:(1)、在基态Mg原子中,核外存在对自旋相反的电子。(2)、碳在矿物中,通常以碳酸盐形式存在。根据价层电子对互斥理论,可推知CO 的空间构型为 , 其中碳原子的杂化轨道类型为。NaHCO3的溶解度比Na2CO3的小,其原因是HCO 在水溶液中易形成多聚离子,请解释HCO 形成多聚离子的原因是。(3)、Ni的基态原子的价层电子排布式为。区分晶体Ni和非晶体Ni的最可靠的科学方法为。向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为。(4)、已知M的晶胞(α = β = γ = 90°)结构如下图所示,则M的化学式为。其晶胞参数为:a = b = c = d pm,该晶体的密度为g·cm-3.(列出计算式)