广东省珠海市2021年高考化学二模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 《珠海经济特区生活垃圾分类管理条例》将于2021年6月1日起正式实施,下列分类错误的是( )A、鱼骨菜叶——厨余垃圾 B、消毒剂及其包装物——有害垃圾 C、踩扁的易拉罐——其他垃圾 D、玻璃瓶——可回收垃圾2. 下列说法错误的是( )A、煤通过气化和液化等物理方法可以分离出芳香烃 B、油脂完全水解的产物中一定含有甘油 C、CH4的热稳定性比SiH4强 D、固态NaOH熔化时只破坏离子键,不破坏共价键3. “连翘酯苷A”是“连花清瘟胶囊”的有效成分。下图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示,下列有关该有机物的说法错误的是( )
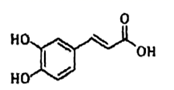 A、分子式为C9H8O4 B、1mol该分子最多可与5molH2发生加成反应 C、分子中所有原子可能处于同一平面 D、1mol连翘酯苷A能与3 mol NaOH溶液反应4. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、密闭容器中,1molH2和1molI2反应后分子总数为2NA B、1mol铁在1mol氯气中燃烧,转移的电子数为3NA C、46gC2H6O完全燃烧,有5NA个C-H键断裂 D、pH=1的1L硫酸溶液中含有0.2NA个H+5. 下列有关化学用语表示正确的是( )A、聚丙烯的结构简式为:
A、分子式为C9H8O4 B、1mol该分子最多可与5molH2发生加成反应 C、分子中所有原子可能处于同一平面 D、1mol连翘酯苷A能与3 mol NaOH溶液反应4. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、密闭容器中,1molH2和1molI2反应后分子总数为2NA B、1mol铁在1mol氯气中燃烧,转移的电子数为3NA C、46gC2H6O完全燃烧,有5NA个C-H键断裂 D、pH=1的1L硫酸溶液中含有0.2NA个H+5. 下列有关化学用语表示正确的是( )A、聚丙烯的结构简式为: B、乙酸的分子式:CH3COOH
C、CO2分子的比例模型:
B、乙酸的分子式:CH3COOH
C、CO2分子的比例模型: 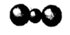 D、用电子式表示HCl的形成过程:
D、用电子式表示HCl的形成过程: 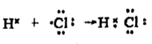 6. 下列实验操作、现象及结论都正确的是( )
6. 下列实验操作、现象及结论都正确的是( )选项
实验操作
现象
结论
A
将红热的碳放入浓硫酸中,产生的气体通入澄清的石灰水中
石灰水变浑浊
碳被浓硫酸氧化成 CO2
B
向NaAlO2溶液中滴入NaHCO3溶液
有白色沉淀生成
AlO2-结合H+的能力比 强
C
将常温下用冷的浓硝酸处理过的铝片插入硫酸铜溶液中
铝片表面无明显现象
用硝酸处理后,铝的金属性减弱
D
向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中
产生白色浑浊
酸性:盐酸>碳酸>硅酸
A、A B、B C、C D、D7. 下列关于离子共存或者离子反应的说法正确的是( )A、 溶液可能大量存在: 、 、 、 B、用NaOH溶液吸收过量CO2: C、 氯化亚铁溶液:Na+、 、 、MnO D、氢氧化铁和碘化氢溶液反应:8. 人们运用化学知识通过辛勤劳动创造了美好的生活。下列说法错误的是( )A、厨房清洗碗碟时可用热的纯碱溶液代替洗洁精,这利用了纯碱的水解原理 B、炉灶使用的燃气由液化石油气改为天然气,应该减少空气的进气量 C、二氧化硫是国内外允许使用的一种食品添加剂,可以大量广泛地用于食品的漂白 D、长途运输中,可用泡过高锰酸钾溶液的硅藻土来防止水果早熟9. 下列有关叙述错误的是( )A、华为Mate系列手机采用的超大容量高密度电池属二次电池 B、珠港澳大桥桥底镶嵌锌块,锌作负极,以防大桥被腐蚀 C、精炼铜工业中,通过2mol电子时,阳极溶解63.5g铜 D、铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:10. 25℃时,下列说法正确的是( )A、向Na2C2O4溶液中加水,溶液中所有离子浓度都减小 B、pH=3的醋酸溶液和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍 C、浓度均为 的三种溶液:NaClO、 、 pH依次增大 D、pH=2的HA溶液和 的MOH溶液等体积混合后,恰好完全反应,则HA为强酸11. 短周期主族元素X、Y、Z、W的原子序数依次增大,元素Y是地壳中含量最多的元素,X与Z同主族且二者可形成离子化合物,W的最外层电子数是其电子层数的2倍,下列说法正确的是( )A、非金属性:X<Y<W B、由这四种元素组成的化合物水溶液可呈酸性 C、元素W的简单氢化物为强酸 D、原子半径:Y<Z<W12. 下列操作能达到相应实验目的的是( )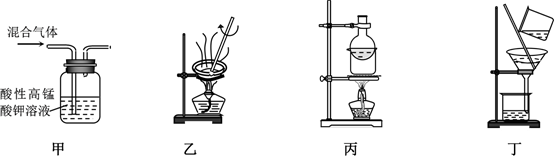 A、用装置甲除去乙烯中的少量SO2 B、用装置乙除去碳酸氢钠中的少量碳酸钠 C、用装置丙除去固体碘中的少量NH4Cl D、用装置丁除去二氧化锰中的少量氯酸钾13. 重质二氧化锰具有优良的电化学性能,广泛应用于各类化学电源中。以硫酸锰为原料制备重质二氧化锰的工艺流程如图,
A、用装置甲除去乙烯中的少量SO2 B、用装置乙除去碳酸氢钠中的少量碳酸钠 C、用装置丙除去固体碘中的少量NH4Cl D、用装置丁除去二氧化锰中的少量氯酸钾13. 重质二氧化锰具有优良的电化学性能,广泛应用于各类化学电源中。以硫酸锰为原料制备重质二氧化锰的工艺流程如图,
下列说法正确的是( )
A、用少量氨水吸收“焙烧”产生的气体,所得溶液可用于“沉锰” B、“焙烧”过程在高压、密闭容器进行转化率更高 C、“沉锰”的主要反应为 D、工艺中的硫酸表现酸性和氧化性14. 在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法错误的是( ) A、该过程中,有极性键O—H的断裂与N—H的生成 B、该过程将太阳能转化成为化学能 C、氧化剂与还原剂的物质的量之比为3:1 D、LDH的作用是吸附和释放H原子15. 2020年7月10日正式上市的比亚迪“汉”汽车,让电动汽车安全达到一个新高度,其配置磷酸铁锂“刀片电池”放电时的总反应: ,工作原理如图所示。下列说法正确的是( )
A、该过程中,有极性键O—H的断裂与N—H的生成 B、该过程将太阳能转化成为化学能 C、氧化剂与还原剂的物质的量之比为3:1 D、LDH的作用是吸附和释放H原子15. 2020年7月10日正式上市的比亚迪“汉”汽车,让电动汽车安全达到一个新高度,其配置磷酸铁锂“刀片电池”放电时的总反应: ,工作原理如图所示。下列说法正确的是( )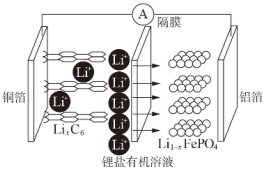 A、放电时,铝箔作负极 B、放电时,Li+通过隔膜移向负极 C、用充电桩给汽车电池充电的过程中,阴极质量减小 D、充电时的阳极反应式为16. 常温下,向 的HA溶液中逐滴加入 的氨水,溶液的pH及导电能力变化趋势如图。下列说法错误的是( )
A、放电时,铝箔作负极 B、放电时,Li+通过隔膜移向负极 C、用充电桩给汽车电池充电的过程中,阴极质量减小 D、充电时的阳极反应式为16. 常温下,向 的HA溶液中逐滴加入 的氨水,溶液的pH及导电能力变化趋势如图。下列说法错误的是( )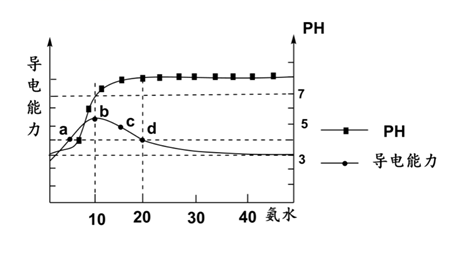 A、b点溶液中,水的电离程度最大 B、溶液中的阳离子浓度总和关系是:b>c>a C、常温下,HA的电离平衡常数约为10-5 D、氨水的电离常数小于HA的电离平衡常数
A、b点溶液中,水的电离程度最大 B、溶液中的阳离子浓度总和关系是:b>c>a C、常温下,HA的电离平衡常数约为10-5 D、氨水的电离常数小于HA的电离平衡常数二、综合题
-
17. 按图连接好装置,如下表清单分别放入不同药品,做多次实验,回答下列问题。
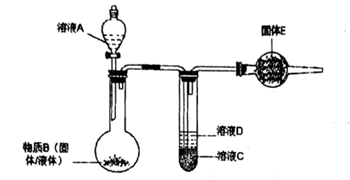
A
B
C
D
E
实验1
70%的H2SO4溶液
Na2SO3固体
Br2的CCl4溶液
BaCl2溶液
碱石灰
实验2
浓盐酸
浓H2SO4
CCl4
淀粉-KI溶液
碱石灰
实验3
饱和氯化钠溶液
电石
?
Br2的苯溶液
碱石灰
实验4
?
?
CCl4
FeCl2和KSCN混合溶液
碱石灰
实验5
苯和溴的混合物
还原铁粉
CCl4
AgNO3溶液
碱石灰
实验6
浓氨水
CaO
Br2的CCl4溶液
水
———
(1)、实验1中,试管内的现象为:溶液C褪色,溶液D中出现白色沉淀(写化学式)。(2)、实验2中,试管内的现象为:。(3)、实验3中,溶液C应该为: , 则D中溶液褪色,证明有乙炔生成。(4)、实验4中,溶液D变为红色,则A和B分别为:。(5)、实验5中,同学们观察到溶液D中出现淡黄色沉淀,据此推断出圆底烧瓶内发生了取代反应,请问这个推断是否合理,并说明理由;。(6)、实验6中,溶液C褪色,并出现白色沉淀,请写出在溶液C中发生的化学反应方程式:。(7)、在实验1、2、6中,溶液C还有一个共同的作用:。18. 一种以铝矿(主要成分为 、 和 等)为原料生产金属铝的工艺流程如下: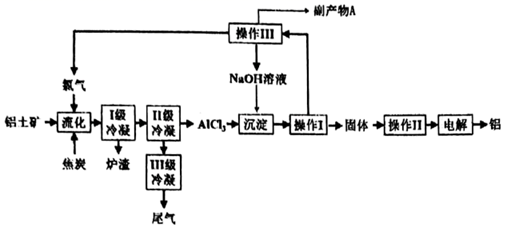
已知几种氯化物在常压时的熔、沸点:
物质
SiCl4
AlCl3
NaCl
KCl
CaCl2
沸点/℃
58
180
1465
—
1935
熔点/℃
-69
—
801
771
775
回答下列问题:
(1)、CaAl2Si2O8用氧化物形式可表示为 .(2)、“流化”阶段温度保持在900℃以上,使铝土矿中物质全部转化为氯化物。①“流化过程中NaAlSi3O8发生的化学反应方程式为 .
②Ⅱ级冷凝的温度不能高于℃
(3)、“操作Ⅱ”的名称是 , “操作Ⅲ”的名称是。(4)、副产物A为;(5)、尾气含有剧毒的COCl2 , 它能被强碱溶液能吸收,其反应的离子方程式为。19. 2021年4月29日,中国空间站的“天和”核心舱成功发射。通过化学方法,比如把H2O转化为O2、把CO2转化为O2 , 可以实现O2的部分自给。研究表明,CO2在一定条件下与H2O发生氧再生反应:(1)、已知:CH4的燃烧热 , 的蒸发热则氧再生反应的
(2)、恒压条件时,按 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。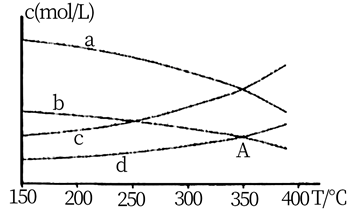
①若 ,则曲线代表CH4。
②350℃时,A点的平衡常数为 (填计算结果),为提高CO2的转化率,除改变温度外,还可采取的措施为。
③关于以上反应,下列说法正确的是(填字母)。
a.CH4和CO2浓度相等时可判断反应到达平衡状态
b.消耗1 mol CO2同时断裂4 mol C-H键可判断反应到达平衡状态
c.平衡后,按起始原料比再充入反应物,维持温度不变,再次达平衡时,甲烷的体积分数不变
d.若体系改为恒温恒容,反应物起始投料比不变,CO2的平衡转化率减小
(3)、氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:
①光催化CO2转化为CH4的阴极方程式为。
②催化剂的催化效率和CH4的生成速随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是。
20. 硒是稀散非金属之一,在光敏材料、电解锰行业催化剂和半导体材料等方面有广泛应用,其在元素周期表中相对位置关系如图所示:
回答下列问题:
(1)、基态硒原子的核外电子排布式为。单质硒的熔点为221℃,其晶体类型。(2)、根据元素周期律,电负性:SeS,第一电离能GaAs。(填“>”“<”或“=”),Se所在主族元素对应氢化物沸点最低的是(填化学式)。(3)、硒的含氧酸有H2SeO3 , H2SeO4。酸性:H2SeO3H2SeO4(填“>”“<”或“=”)(4)、SeO3是一种无色晶状物,空气中易吸潮。请问Se原子的杂化方式为 , SeO3的空间构型为。(5)、硒化锌材料是一种黄色透明的多晶材料,用于制造透红外线材料及红外线光学仪器,其晶胞如图所示(其中白色球表示硒原子),Zn原子的配位数为 , 已知晶胞边长参数为anm,NA表示阿伏加德罗常数,则紧邻的Se2-与Zn2+之间的距离为nm(列出表达式),硒化锌的密度为g·cm-3(列出计算式)。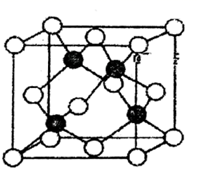 21. 化合物G是合成一种心血管药物的中间体,其合成路线如下:
21. 化合物G是合成一种心血管药物的中间体,其合成路线如下: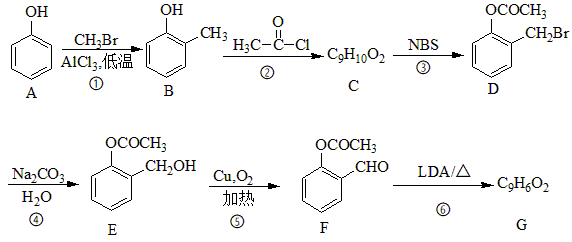
已知:
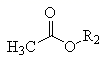
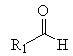 +
+ 
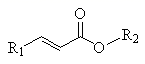 +H2O
+H2O回答下列问题:
(1)、B的化学名称是 , C反应生成D的反应类型是 , F的含氧官能团名称是。(2)、物质G的结构中有两个六元环,其结构简式为(3)、写出B反应生成C的化学方程式。(4)、D反应生成E时用Na2CO3水溶液而不用NaOH溶液的原因是。(5)、H是E的同分异构体,写出符合下列条件的H的结构简式(写出一种即可)。①1 mol H可以消耗1 mol Na生成氢气
②1 mol H可以和3 mol NaOH反应
③核磁共振氢谱共有4个吸收峰,峰面积之比为6:2:1:1
(6)、设计由甲醇和乙酸乙酯制备丙酸乙酯( )的合成路线(无机试剂任选)。
)的合成路线(无机试剂任选)。