广东省广州市天河区2021年高考化学三模试卷
试卷更新日期:2021-07-01 类型:高考模拟
一、单选题
-
1. 华夏文明源远流长,勤劳智慧的中国人民探索认知世界,创造美好生活的过程贯穿始终。以下说法从化学视角理解错误的是( )
A
高奴出脂水,颇似淳漆,燃之如麻
文中提到的“脂水”是指汽油
B
日照澄洲江雾开,淘金女伴满江隈
诗中包含了丁达尔效应
C
水银乃至阴之毒物,因火煅丹砂而出
这段记载中,涉及氧化还原反应
D
采蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如“石”,浣衣发面
“石”主要是K2CO3 , 溶液显碱性
A、A B、B C、C D、D2. 现代社会的发展与进步离不开材料。下列有关材料的说法错误的是( )A、港珠澳大桥路面使用了沥青和混凝土,沥青可以通过石油分馏得到 B、人民币票面文字等处采用含Fe3O4的磁性油墨,Fe3O4常用作红色颜料 C、射电望远镜“中国天眼”的“眼眶”是钢铁结成的圈梁,钢铁属于合金 D、芯片制造用到的光刻胶含聚乙烯醇月桂酸酯,聚乙烯醇月桂酸酯属于有机高分子材料3. 生命在于运动,而生命活动的维持离不开能量,糖类、油脂、蛋白质是基本营养物质。下列说法正确的是( )A、糖类、油脂、蛋白质都能发生水解反应 B、糖尿病人食用的“无糖饼干”主要成分为面粉,不含糖类物质 C、我国新冠疫苗安全有效,助力全球抗疫,疫苗无需经冷链运输 D、豆腐是我国古代劳动人民智慧的结晶,蛋白质在人体内水解的最终产物为氨基酸4. 物质性质决定其用途,物质用途反映其性质。下列物质用途与性质对应关系错误的是( )选项
用途
性质
A
SiO2用作光导纤维
SiO2能把光的强弱转变为电流的强弱
B
工业上用纯碱去油污
Na2CO3溶液水解呈碱性,油脂碱性条件下水解程度大
C
明矾用作净水剂
明矾溶于水形成Al(OH)3胶体,吸附水中悬浮杂质形成沉淀
D
三元催化器处理汽车尾气
尾气中CO有还原性,NOx有氧化性。在催化剂作用下转化为CO2和N2
A、A B、B C、C D、D5. 一种药物中间体的结构如图所示。下列说法错误的是( ) A、分子式为C12H6O3 B、该化合物所有碳原子共平面 C、二氯代物有9种 D、能使溴水和酸性KMnO4溶液褪色6. 关于常温下0.1mol•L-1的醋酸溶液,下列叙述正确的是( )A、溶液中c(H+)=c(CH3COO-) B、加水稀释后,溶液中所有离子的浓度均减小 C、加入醋酸钠晶体后,溶液的pH增大 D、加入等体积、pH=13的NaOH溶液后,c(Na+)=c(CH3COO-)7. 设NA为阿伏加德罗常数的数值,下列说法中正确的是( )A、3 mol NO2与水充分反应,转移NA个电子 B、常温常压下,18 g H2O含有3NA个原子 C、1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1 NA个HCO
A、分子式为C12H6O3 B、该化合物所有碳原子共平面 C、二氯代物有9种 D、能使溴水和酸性KMnO4溶液褪色6. 关于常温下0.1mol•L-1的醋酸溶液,下列叙述正确的是( )A、溶液中c(H+)=c(CH3COO-) B、加水稀释后,溶液中所有离子的浓度均减小 C、加入醋酸钠晶体后,溶液的pH增大 D、加入等体积、pH=13的NaOH溶液后,c(Na+)=c(CH3COO-)7. 设NA为阿伏加德罗常数的数值,下列说法中正确的是( )A、3 mol NO2与水充分反应,转移NA个电子 B、常温常压下,18 g H2O含有3NA个原子 C、1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1 NA个HCO D、标准状况下,2.24 L乙醇含有0.1NA个CH3CH2OH分子
8. 从海带中提取碘,下列实验操作不能达到实验目的的是( )
D、标准状况下,2.24 L乙醇含有0.1NA个CH3CH2OH分子
8. 从海带中提取碘,下列实验操作不能达到实验目的的是( )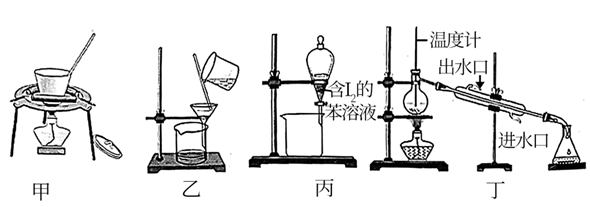 A、装置甲灼烧海带 B、装置乙过滤海带灰 C、装置丙萃取碘单质 D、装置丁分离碘和苯9. 已知碳酸氢铵是一种常用氨肥,20℃以下稳定,工业生产NH4HCO3的工艺如图所示,下列说法错误的是( )
A、装置甲灼烧海带 B、装置乙过滤海带灰 C、装置丙萃取碘单质 D、装置丁分离碘和苯9. 已知碳酸氢铵是一种常用氨肥,20℃以下稳定,工业生产NH4HCO3的工艺如图所示,下列说法错误的是( )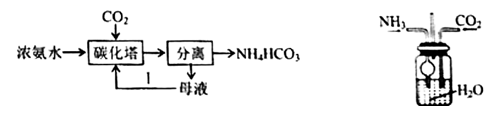 A、碳化塔中充入高压CO2能提高碳化速率 B、分离操作包括加压蒸发、浓缩结晶、趁热过滤 C、设计过程I是为了提高原料的利用率 D、实验室可以用如图装置模拟碳化塔制取少量NH4HCO310. 中国向世界郑重承诺,努力争取2060年前完成“碳中和”。一种微生物电解池(MEC)既可以处理有机废水,又有助于降低碳排放,其工作原理如图所示。下列说法错误的是( )
A、碳化塔中充入高压CO2能提高碳化速率 B、分离操作包括加压蒸发、浓缩结晶、趁热过滤 C、设计过程I是为了提高原料的利用率 D、实验室可以用如图装置模拟碳化塔制取少量NH4HCO310. 中国向世界郑重承诺,努力争取2060年前完成“碳中和”。一种微生物电解池(MEC)既可以处理有机废水,又有助于降低碳排放,其工作原理如图所示。下列说法错误的是( )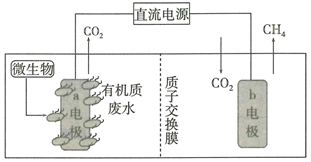 A、a电极为MEC的阳极 B、MEC工作时,质子将从a电极室向b电极室迁移 C、b电极的电极反应式为CO2+8e-+8H+=CH4+2H2O D、a电极室产生的CO2与b电极室消耗的CO2相等11. 高效消毒液(TCCA)结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素。已知Y和Z位于不同周期,下列叙述错误的是( )
A、a电极为MEC的阳极 B、MEC工作时,质子将从a电极室向b电极室迁移 C、b电极的电极反应式为CO2+8e-+8H+=CH4+2H2O D、a电极室产生的CO2与b电极室消耗的CO2相等11. 高效消毒液(TCCA)结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素。已知Y和Z位于不同周期,下列叙述错误的是( ) A、原子半径:W>X>Y B、X的气态氢化物能使湿润的红色石蕊试纸变蓝 C、14W与14X属于不同元素,但属于同一核素 D、该化合物中所有原子均满足8电子稳定结构12. 我国推行的新型冠状病毒防治方案,明确指出应当使用含氯消毒液进行消毒。氯气与冷烧碱溶液反应可制得“84”消毒液,实验装置如图。下列有关说法错误的是( )
A、原子半径:W>X>Y B、X的气态氢化物能使湿润的红色石蕊试纸变蓝 C、14W与14X属于不同元素,但属于同一核素 D、该化合物中所有原子均满足8电子稳定结构12. 我国推行的新型冠状病毒防治方案,明确指出应当使用含氯消毒液进行消毒。氯气与冷烧碱溶液反应可制得“84”消毒液,实验装置如图。下列有关说法错误的是( )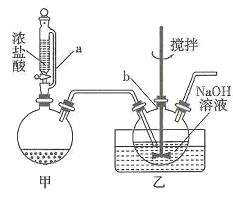 A、甲中盛放的试剂可以是高锰酸钾固体 B、乙中可采用热水浴,有利于加快反应速率 C、在甲、乙之间加入饱和食盐水洗气,可提高NaOH利用率 D、在乙之后再连接NaOH溶液吸气,更加符合绿色化学思想13. 某兴趣小组依据以下方案将KI、Na2S2O3和淀粉溶液混合后,再加入K2S2O8溶液,探究反应条件对反应速率的影响。已知:S2O +2I-=I2+2SO (慢),2S2O +I2=2I-+2SO (快)。下列说法错误的是( )
A、甲中盛放的试剂可以是高锰酸钾固体 B、乙中可采用热水浴,有利于加快反应速率 C、在甲、乙之间加入饱和食盐水洗气,可提高NaOH利用率 D、在乙之后再连接NaOH溶液吸气,更加符合绿色化学思想13. 某兴趣小组依据以下方案将KI、Na2S2O3和淀粉溶液混合后,再加入K2S2O8溶液,探究反应条件对反应速率的影响。已知:S2O +2I-=I2+2SO (慢),2S2O +I2=2I-+2SO (快)。下列说法错误的是( )实验序号
体积/mL
K2S2O8溶液
KI溶液
Na2S2O3溶液
淀粉溶液
1
10.0
4.0
4.0
2.0
2
8.0
4.0
4.0
2.0
A、将KI、Na2S2O3和淀粉溶液混合后,加入K2S2O8溶液,溶液不会立即变蓝 B、当溶液中的Na2S2O3完全耗尽,溶液将由无色变为蓝色 C、依据上述方案,通过颜色变化出现的快慢,可以说明反应物浓度对速率的影响 D、为了确保能观察到颜色变化,Na2S2O3和K2S2O8初始物质的量之比应小于214. 一种烟气治理中的脱硝原理如图所示,下列说法错误的是( ) A、反应的催化剂为V4+-O-H B、总反应方程式为:4NH3+3O2 2N2+6H2O C、反应过程中V的化合价有变化 D、虚线框内的变化不属于化学变化15. 我国著名化学家付鹰说:“化学是实验的科学,只有实验才是最高法庭”。下列实验操作、现象和结论均正确的是( )
A、反应的催化剂为V4+-O-H B、总反应方程式为:4NH3+3O2 2N2+6H2O C、反应过程中V的化合价有变化 D、虚线框内的变化不属于化学变化15. 我国著名化学家付鹰说:“化学是实验的科学,只有实验才是最高法庭”。下列实验操作、现象和结论均正确的是( )选项
操作
现象
结论
A
向某溶液中依次摘入几滴KSCN溶液和新制氯水
溶液先无明显现象,后变红
该溶液中含Fe2+
B
将一小块金属钠放在蒸发皿里,加热
发出黄色火焰,生成淡黄色固体
金属钠在空气中加热生成过氧化钠
C
用排水法收集铜和稀硝酸加热产生的气体
集气瓶中充满红棕色气体
反应生成红棕色气体且不溶于水
D
向1mL0.1mol•L-1NaOH溶液中依次滴入2滴浓度均为0.1mol•L-1的MgCl2溶液和FeCl3溶液
先产生白色沉淀,后生成红褐色沉淀
相同温度下:Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
A、A B、B C、C D、D16. 已知常温下NH3•H2O的电离平衡常数Kb=1.8×10-5。常温下向1L0.1mol•L-1的NH4Cl溶液中不断加入NaOH固体,溶液中NH 和NH3•H2O的物质的量浓度变化曲线如图所示(忽略溶液体积变化)。下列说法正确的是( )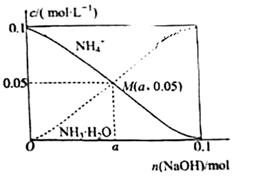 A、M点时,加入的NaOH少于0.05mol B、M点时,溶液pH=7 C、M点时,c(OH-)+0.05=a+c(H+) D、n(NaOH)=0.05mol时,c(Cl-)>c(NH )>c(H+)>c(OH-)
A、M点时,加入的NaOH少于0.05mol B、M点时,溶液pH=7 C、M点时,c(OH-)+0.05=a+c(H+) D、n(NaOH)=0.05mol时,c(Cl-)>c(NH )>c(H+)>c(OH-)二、综合题
-
17. 某学习小组设计了如图装置用于制取SO2并验证其性质。
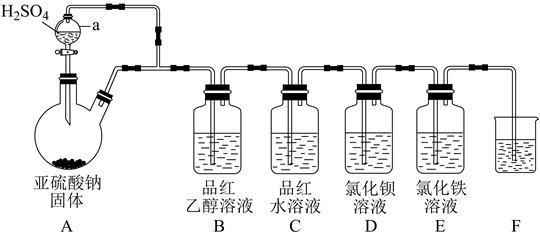 (1)、仪器a的名称为 , 实验时装置E中溶液的现象为。(2)、若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是(填化学式)。(3)、该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。
(1)、仪器a的名称为 , 实验时装置E中溶液的现象为。(2)、若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是(填化学式)。(3)、该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。
①装置中浓硫酸的作用为。
②根据表中实验现象做出合理解释。
组别
实验现象
合理解释
甲
品红溶液几乎不褪色
反应方程式为
乙
品红溶液随时间的推移变得越来越浅
原因可能是
(4)、该实验小组的学生丙预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如图实验: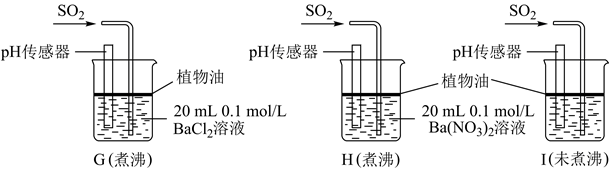 实验中G、H、I烧杯中观察到的现象如表:
实验中G、H、I烧杯中观察到的现象如表:烧杯
实验现象
G
无白色沉淀产生,pH传感器测的溶液pH=5.3
H
有白色沉淀产生
I
有白色沉淀产生,I中出现白色沉淀比H中快很多
①据G中现象推测D中产生的白色沉淀的化学式是。
②写出H中白色沉淀产生的离子方程式。
③据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是。
(5)、该实验小组的学生丁用200mL0.1mol•L-1酸性KMnO4溶液测定空气中SO2含量,若气体流速为acm3•min-1 , 当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为(g•cm-3)。18. 某油脂厂废弃的油脂加氢所用催化剂主要含金属Ni、Al、Fe及他们的氧化物,还有少量其他不溶性杂质。采用如图工艺流程回收其中的镍来制备硫酸镍晶体(NiSO4•7H2O): 溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时的pH(c=1.0mol•L-1)
6.2
3.7
2.2
7.5
沉淀完全时的pH(c=1.0×10-5mol•L-1)
8.7
4.7
3.2
9.0
(1)、废镍催化剂上的油脂在过程中被处理,滤液①中含有的无机阴离子有OH-、。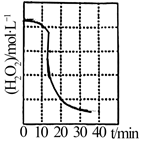 (2)、“转化”过程中反应的化学方程式为 , c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因是。(3)、利用表格数据,计算Ni(OH)2的Ksp= , “转化”后的溶液中Ni2+的浓度为1.0mol•L-1 , “调pH”应控制的pH范围是。(4)、进行操作I前通常要在滤液③中加入少量稀硫酸,作用为。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH,反应的离子方程式为。19. 研究减少CO2排放是一项重要课题。CO2催化加氢生成乙烯等低碳烯烃,进而制取液态烃,作为低碳液态燃料。制取乙烯发生的主要反应有:
(2)、“转化”过程中反应的化学方程式为 , c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因是。(3)、利用表格数据,计算Ni(OH)2的Ksp= , “转化”后的溶液中Ni2+的浓度为1.0mol•L-1 , “调pH”应控制的pH范围是。(4)、进行操作I前通常要在滤液③中加入少量稀硫酸,作用为。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH,反应的离子方程式为。19. 研究减少CO2排放是一项重要课题。CO2催化加氢生成乙烯等低碳烯烃,进而制取液态烃,作为低碳液态燃料。制取乙烯发生的主要反应有:i.2CO2(g)+6H2(g) ⇌C2H4(g)+4H2O(g)△H=-127.89kJ•mol-1
ii.CO2(g)+H2(g) ⇌H2O(g)+CO(g)△H=+41.2kJ•mol-1
(1)、CO2催化加氢制乙烯包括两个步骤:步骤I:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)+CO(g)△H=-49.5kJ•mol-1 , 写出步骤II由甲醇制乙烯的热化学方程式。
(2)、不同压强下CO2的平衡转化率与温度的关系如图:
①400~600℃,CO2的平衡转化率随着压强的升高而增大,B点v正A点v逆(填“>”“<”或“=”)。在A点给定的温度和压强下,提高CO2平衡转化率的方法有。(任写一种)
②在恒定压强下,随着温度的升高,CO2的平衡转化率先降低后升高。试分析可能原因。
③根据图像可知,为了获得更多乙烯等低碳烯烃,反应条件应控制在(填序号)。
A.压强0.1~1.0MPa B.温度300~400℃
C.压强2.0~3.0MPa D.温度900~1000℃
一定条件下,将H2和CO2[n(H2):n(CO2)=3]以一定的流速通过K—Fe—MnO/Al2O3催化剂进行反应,测得CO2的平衡转化率为50.0%,C2H4和CO的物质的量之比为2∶1,反应i的化学平衡常数Kp=(只列算式不计算)。不改变气体流速和温度,一定能提高C2H4选择性的措施有。(任写二种)
20. 2019年诺贝尔化学奖授予约翰•古德伊纳夫、斯坦利•惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:(1)、LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为 , 基态磷原子中,电子占据的最高能层符号为 , 该能层能量最高的电子云在空间有个伸展方向,原子轨道呈形。(2)、[CO(NO )4]2-中Co2+的配位数为4,配体中N原子的杂化方式为 , 该配离子中各元素的第一电离能由小到大的顺序为(填元素符号),1mol该配离子中含σ键数目为NA。(3)、MnCl2可与NH3反应生成[Mn(NH3)6]Cl2 , 新生成的化学键为键。NH3分子的空间构型为 , 其中N原子的杂化轨道类型为。(4)、钴蓝晶体结构如图,该立方晶胞由4个I型和4个II型小立方体构成,共化学式为 , 晶体中Al3+占据O2-形成的(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数得值,钴蓝晶体的密度为g•cm-3(列计算式)。
21. 有机物G是一种合成药物的重要中间体,其合成路线如图所示:
回答下列问题:
(1)、有机物A的名称为 , A→B的反应类型为。(2)、B→C的化学方程式为 , D中含氧官能团的名称为。(3)、有机物H是F与足量氢气加成反应的产物,H中含有个手性碳原子。(4)、C有多种同分异构体,满足下列条件的3种同分异构体的结构简式为。①能与NaHCO3溶液发生反应产生CO2;
②既能发生银镜反应,又能发生水解反应且水解产物酸化后可使FeCl3溶液显紫色;
③核磁共振氢谱有6组峰,且峰面积之比为6:2:2:2:1:1。
(5)、请参照上述合成信息,以苯、 及CH3MgBr为原料设计
及CH3MgBr为原料设计  的合成路线。
的合成路线。