2021年科学中考真题分类汇编15:酸碱盐与金属1
试卷更新日期:2021-06-29 类型:二轮复习
一、单选题
-
1. 如图是我们常见的水果及其近似pH,其中酸性最强的是( )A、西瓜pH=6.6
 B、葡萄pH=5.1
B、葡萄pH=5.1  C、猕猴桃pH=3.3
C、猕猴桃pH=3.3  D、桔子pH=3.6
D、桔子pH=3.6 
-
2. 台州气候适宜,盛产各种酸甜爽口的水果。深受市民喜爱,分析下表,酸性最强的水果是( )
水果名称
东魁杨梅
涌泉蜜桔
楚门文旦
玉麟西瓜
pH值
2.5~3.5
4.0-5.0
4.5~5.5
5.5-6.5
A、东魁杨梅 B、涌泉蜜桔 C、楚门文旦 D、玉麟西瓜 -
3. 小明将纸条分别紧紧卷在木棒和铁棒上,加热纸条(如图),木棒上的纸条立即燃烧,面铁棒上的纸条不会立即燃烧。据此推测木棒和铁棒具有不同的( )
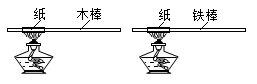 A、密度 B、导热性 C、硬度 D、延展性
A、密度 B、导热性 C、硬度 D、延展性 -
4. 小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )A、
 B、
B、 C、
C、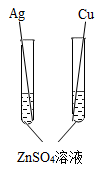 D、
D、
-
5. 盐酸在生产和生活中的用途很广,能与多种物质发生反应。下列物质与盐酸反应时,能观察到白色沉淀的是( )A、
 B、
B、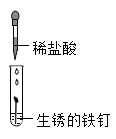 C、
C、 D、
D、
-
6. 不同品牌的洗手液pH一般不同,25℃时四种洗手液的pH如图所示。下列说法错误的是( )
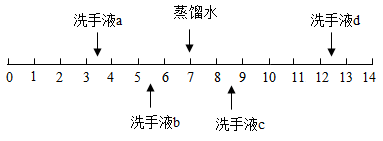 A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于7
A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于7 -
7. 如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
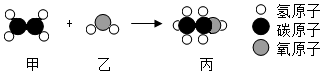 A、该反应属于化合反应 B、甲、乙、丙都是有机物 C、该反应中参加反应的甲和乙质量比为1:1 D、该反应在反应前后原子的种类发生了改变
A、该反应属于化合反应 B、甲、乙、丙都是有机物 C、该反应中参加反应的甲和乙质量比为1:1 D、该反应在反应前后原子的种类发生了改变 -
8. 含硫元素的同类物质中硫元素的化合价可能不同,不同类物质中硫元素的化合价可能相同,如表所示。下列判断正确的是( )
类别
物质
化合价
单质
氧化物
酸
X
0
a
-
-
-
+4
-
b
d
Na2SO3等
+6
-
c
e
f
A、X表示碱 B、物质a在空气中燃烧会发出明亮的蓝紫色火焰 C、物质b是二氧化硫,它是空气污染物之一 D、物质d和NaOH溶液发生中和反应生成Na2SO4和H2O -
9. 下列有关说法正确的是( )A、O2具有助燃性 B、铁生锈属于物理变化 C、金属活动性Cu比Mg强 D、KClO3属于氧化物
-
10. 取稀盐酸与氢氧化钠反应后的溶液进行实验下列能说明稀盐酸、氢氧化钠恰好都完全反应的是( )A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、加酚酞试液,溶液显红色 D、测定溶液的pH,刚好显中性
-
11. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
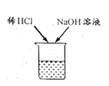 A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于7
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于7 -
12. 金华酒传统酿造技艺、浦江剪纸、永康锡雕、东阳竹编等,是金华拥有的众多国家级非物质文化遗产的典型代表。下列非物质文化遗产制作过程,主要利用化学变化的是( )A、酿酒
 B、剪纸
B、剪纸  C、锡雕
C、锡雕  D、竹编
D、竹编 
-
13. 通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )A、
 B、
B、 C、
C、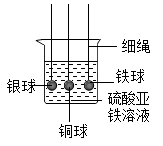 D、
D、
-
14. 铕(Eu)是非常活泼的金属,能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为:Eu+2H2O=Eu(OH)2↓+H2↑。该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应
-
15. 因胃酸过多引起的胃病可用抗酸剂治疗。下列常用抗酸剂中,属于氧化物的是( )A、MgO B、CaCO3 C、NaHCO3 D、Al(OH)3
-
16. 我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应式是: ① 2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO;②2Mg+TiCl4 2MgCl2+Ti 下列说法合理的是( )A、FeTiO3属于氧化物 B、钛合金是一种金属单质 C、反应②属于置换反应 D、TiCl4中钛元素和氯元素的质量比为96:71
-
17. 现有锌、氧化铜、硫酸钡和石灰石四种固体,为了区分它们,小嘉参照二歧分类检索表制作了一个物质检索表,如表所示。

下列叙述错误的是( )
A、甲表示的是石灰石 B、乙表示的是锌 C、表中“ “应该表示为“黑色固体” D、也可根据是否含有氧元素对丙、丁分类 -
18. 在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
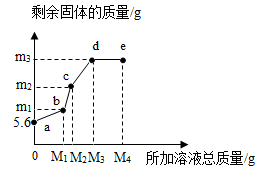 A、所加溶液质量为M1g时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)2
A、所加溶液质量为M1g时,生成Cu的质量为m1g B、bc段发生的是Cu和AgNO3溶液的反应 C、m3的值为21.6 D、e点溶液中不含Cu(NO3)2 -
19. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )
①滤渣中可能有铜 ②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2 , 可能有Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
A、①② B、①③ C、②③ D、②④
二、填空题
-
20. 从生活经验到定性实验,再到定量实验,科学方法的进步推动科学的发展。
材料一:公元前,亚里士多德认为万物都是由火、空气、土和水四种元素组成的,他把元素定义为其他物体可以分解成它,而它本身不能再分割成其他物体。
材料二:17世纪,玻义耳认为元素是只能通过实验证明不能再进一步分解的物质。他把严密的定性实验方法引入科学中,认识到“混合”和“化合”的不同,把“混合”叫“机械混合”,把“化合”叫“完全混合”。
材料三:18世纪,卡文迪许用酸与金属反应得到“易燃空气”,这种气体在空气中燃烧形成小露珠。拉瓦锡知道后,进行定量实验,发现“易燃空气”与“氧”化合生成水的质量?两种气体消耗的质量,从而得出水是两种气体的化合物,而不是一种元素。
根据材料,回答下列问题:
(1)、“完全混合”后的物质,其类别属于纯净物中的。(2)、材料三作为“水不是一种元素"的证据,应在“?”处填。 -
21. 如图所示,将铁片和铜片插入稀硫酸中,电流表指针发生偏转,此时指针位置如图乙所示,则电流大小为安。装置中的虚线框部分相当于电路中的电源、铜片是电源的极。在其它都不变时,将铁换成更活泼的金属X,产生了更大的电流、则金属X可能是(选填“锌”、“银”或“铜")
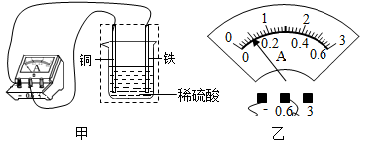
-
22. 有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。

则:
(1)、无色溶液A中一定含有的溶质是。(2)、白色粉末的成分是。 -
23. 实验室常用锌和稀硫酸来制取氢气,向盛有稀硫酸溶液的烧杯中加入足量的锌至反应完全。
 (1)、写出该反应的化学方程式。(2)、如图的
(1)、写出该反应的化学方程式。(2)、如图的 表示溶液中由溶质电离产生的不同离子,则“●”表示(填写离子符号)
表示溶液中由溶质电离产生的不同离子,则“●”表示(填写离子符号) -
24. 温州地区端午节有吃粽子的习俗,其中“灰汤粽”特别受欢迎。制作灰汤粽的关键是做好“灰汤”。
 (1)、作为粽子品质改良剂、防腐剂的灰汤富含碳酸钾。碳酸钾水溶液呈碱性,这是碳酸钾的(选填“物理性质”或“化学性质”)(2)、制作灰汤时,用沸水浇淋草木灰(如图),比用冷水浇淋可得到溶质质量分数更大的碳酸钾溶液。这说明物质的溶解性受影响。(3)、灰汤粽是将糯米用棕叶包裹,放在灰汤中煮制而成。灰汤粽中为人体提供能量的主要营养素是。
(1)、作为粽子品质改良剂、防腐剂的灰汤富含碳酸钾。碳酸钾水溶液呈碱性,这是碳酸钾的(选填“物理性质”或“化学性质”)(2)、制作灰汤时,用沸水浇淋草木灰(如图),比用冷水浇淋可得到溶质质量分数更大的碳酸钾溶液。这说明物质的溶解性受影响。(3)、灰汤粽是将糯米用棕叶包裹,放在灰汤中煮制而成。灰汤粽中为人体提供能量的主要营养素是。 -
25. 2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
 (1)、出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜(选填“强”或“弱”)。(2)、古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 。(3)、应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中 数不同。
(1)、出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜(选填“强”或“弱”)。(2)、古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 。(3)、应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中 数不同。 -
26. 学习了物质推断专题内容后,科学研究小组同学设计了如下实验方案进行探究。步骤如下:
①往镁粉和氧化铜的混合物中加入过量稀硫酸,充分反应并过滤,得到滤渣甲和滤液A;
②往滴有无色酚酞的氢氧化钠和硝酸钡的混合溶液中,加入一定量的稀硫酸,充分反应并过滤,得到沉淀乙和无色滤液B;
③将滤液A和B充分混合后,得到沉淀丙和滤液C; ④往滤液C中滴加氯化钡溶液,没有沉淀产生。
回答下列问题:
(1)、步骤②中沉淀乙的化学式为;(2)、滤液C中除酚酞外,一定含有的溶质是。
三、解答题
-
27. 实验室有一瓶敞口放置的氢氧化钠固体样品,为探究样品中的成分,小科进行如下实验:
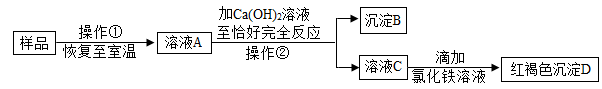 (1)、操作①是加水充分溶解,操作②的名称是。(2)、沉淀B的化学式是。(3)、小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由。。
(1)、操作①是加水充分溶解,操作②的名称是。(2)、沉淀B的化学式是。(3)、小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由。。 -
28. 钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙、现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
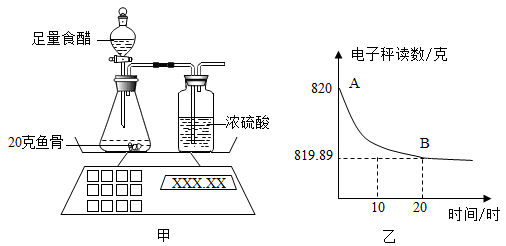
提示:①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为:
CaCO3+2HAc=CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)、该实验中浓硫酸的作用是。(2)、由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是(选填“变大”、“变小”或“不变”)。(3)、根据图中的数据计算鱼骨中碳酸钙的质量分数。(4)、生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明。 -
29. 小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
碳酸钠溶液总质量/g
25.0
50.0
75.0
100.0
125.0
150.0
175.0
200.0
气体总质量/g
1.1
2.2
2.2
2.2
2.2
2.2
2.2
2.2
沉淀总质量/g
0
0
2.5
5.0
m
n
9.0
9.0
(1)、表中n=。(2)、所取的反应后50g溶液中溶质是 。(3)、所用碳酸钠溶液中溶质的质量分数是多少? -
30. 按我国政府要求2021年1月1日起餐饮行业已禁用不可降解的一次性塑料吸管,取而代之的是一些可降解的环保吸管,环保纸吸管的主要成分是纤维素,化学式为(C6H10O5)n,而原来塑料吸管的主要成分是聚丙烯,化学式为(C3H6)n。(1)、纤维素是一种(选填“有机物”或“无机物”)。(2)、纤维素分子中,氢、氧原子的个数比为 。(3)、计算32.4克纤维素中所含碳元素质量与多少克聚丙烯中所含碳元素质量相同?
-
31. 2021年3月,中央财经会议明确把碳达峰、碳中和纳入生态文明建设整体布局,争取在2060年前实现碳中和。“碳中和”是指在一定时间内产生的二氧化碳排放总量,通过二氧化碳去除手段来抵消掉这部
分碳排放,达到“净零排放”的目的。(1)、二氧化碳是引起温室效应的主要气体,根据图甲回答支持这一结论的信息是: 。
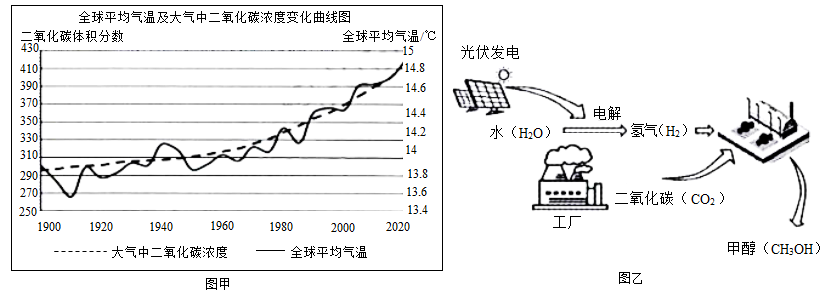 (2)、科学家已经研究出多种方式来实现二氧化碳的转化。
(2)、科学家已经研究出多种方式来实现二氧化碳的转化。①浙江大学研发的“二氧化碳烟气微藻减排技术”,利用微型藻类吸收二氧化碳实现固碳。微型藻类是(选填“真核”或“原核”)生物,该技术的本质是利用微藻的作用实现固碳。
②固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于变化(选填“物理”或“化学”)。
③我国研发的“液态太阳燃料合成技术”(乙),甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇制取过程中能量转化是太阳能→电能→ 能。
甲醇合成时,若碳元素全部来自于二氧化碳,则制取10吨甲醇需要消耗二氧化碳 吨。
(二氧化碳转化成甲醇的方程式为:CO2+3H2 CH3OH+H2O)
(3)、交通领域的“以电代油”可以来实现“减碳”目标。图丙为某纯电动汽车与某燃油汽车的相关数据,
请回答:
①与燃油汽车相比,纯电动汽车每行驶100km会向空气减少排放kg的二氧化碳。
(ρ汽油=0.7×103kg/m3 , 结果精确到0.1)
②从获取电能的各种方式看,相对于燃煤发电,符合“减碳”理念的是发电。
-
32. 取敞口放置的氢氧化钠溶液于烧杯中,倒入一定量的稀硫酸充分反应。为探究反应后所得溶液X的成分,兴趣小组进行了如下实验(所加试剂均足量):
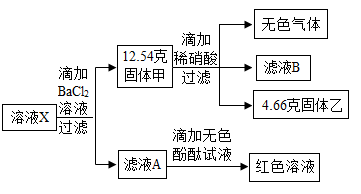 (1)、过滤中玻璃棒的作用是 。(2)、产生的无色气体是 。(3)、溶液X的溶质是。(4)、计算滤液A中氯化钠的质量。
(1)、过滤中玻璃棒的作用是 。(2)、产生的无色气体是 。(3)、溶液X的溶质是。(4)、计算滤液A中氯化钠的质量。
四、实验探究题
-
33. 有一瓶气体,可能由O2、CO、CO2中的一种或几种组成。为确定其组成,在老师的指导下,实验小组对该瓶气体进行了如下探究:
[查阅资料]脱氧剂(还原铁粉)能够吸收氧气和水蒸气。
[实验设计]用下图所示的装置进行实验(已略去夹持装置)。
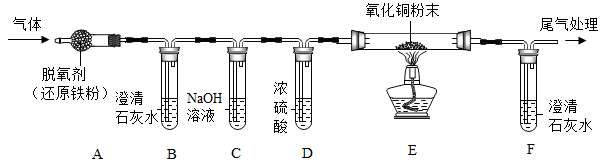
[实验步骤]①检查装置气密性;②通入一定量氮气;③通入该气体,点燃酒精灯。
[实验现象]步骤③实验过程中,A装置无现象,B和F装置出现白色沉淀,E装置中出现光亮的红色物质。
(1)、[实验结论]该气体由组成。(2)、[实验反思]C装置的作用是。(3)、步骤②通入一定量氮气的目的是。(4)、E装置中氧化铜粉末发生反应的化学方程式为。 -
34. 小金为了探究氧化铜与氢气的反应和反应产物,用如图所示装置进行实验。注射器内装满氢气,并将200mL注射器针头扎入橡皮塞中,将少许氧化铜粉末送入长柄U形石英玻璃管内并平铺于管底。将少量白色的无水硫酸铜粉末送入长柄U形石英玻璃管中并平铺于直管中部。然后将一个气球套在长柄U形石英玻璃管的直管出口处,连接好整个实验装置并检查装置气密性……
 (1)、为确保实验安全,在点燃酒精灯加热前的操作是。(2)、装置末端连接的气球的作用是。(3)、实验过程中,当观察到现象时可判断一定有产物水生成。(4)、实验开始时加入a克纯氧化铜粉末,实验结束后取出U形管底的固体称量为b克,当b为(用含有a式子表示)时,可判断氧化铜已完全转化为铜。
(1)、为确保实验安全,在点燃酒精灯加热前的操作是。(2)、装置末端连接的气球的作用是。(3)、实验过程中,当观察到现象时可判断一定有产物水生成。(4)、实验开始时加入a克纯氧化铜粉末,实验结束后取出U形管底的固体称量为b克,当b为(用含有a式子表示)时,可判断氧化铜已完全转化为铜。 -
35. 某种粗盐水中有少量含SO42-、K+的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
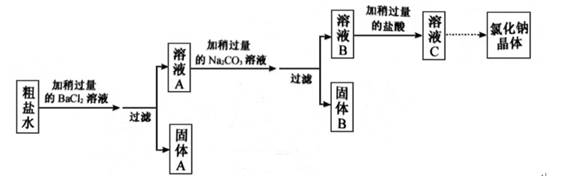 (1)、固体A是。(填化学式)(2)、加碳酸钠溶液时发生反应的化学方程式。(3)、若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得体仍不是纯净的氯化钠,理由是。
(1)、固体A是。(填化学式)(2)、加碳酸钠溶液时发生反应的化学方程式。(3)、若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得体仍不是纯净的氯化钠,理由是。 -
36. 牙是人体口腔内的消化器官,而龋齿(俗称蛀牙是青少年中发生率很高的牙病。(1)、下列龋齿形成的过程中,哪一环节会导致患者感觉到剧烈牙疼?。
 (2)、使用含氟牙膏是预防龋齿的一种有效途径,但过量摄入氟化物,也会引起氟斑牙等疾病,因此在含氟牙膏上往往标明:六岁及以下儿童使用豌豆大小牙膏,在成人指导下刷牙。估测豌豆大小牙膏的体积约为 。A、0.3mm3 B、0.3cm3 C、0.3dm3 D、0.3m3(3)、含氟牙膏中摩擦剂的种类对氟化物能否有效预防龋齿有较大影响。假如某含氟牙膏中使用的摩擦剂分可能为碳酸钙、水合硅石不溶于水且不与盐酸反应)中的一种或两种,而牙膏的其他成分均能溶于水且不与盐酸反应。请设计实验探究此牙膏中摩擦剂的成分。(写出实验思路即可)
(2)、使用含氟牙膏是预防龋齿的一种有效途径,但过量摄入氟化物,也会引起氟斑牙等疾病,因此在含氟牙膏上往往标明:六岁及以下儿童使用豌豆大小牙膏,在成人指导下刷牙。估测豌豆大小牙膏的体积约为 。A、0.3mm3 B、0.3cm3 C、0.3dm3 D、0.3m3(3)、含氟牙膏中摩擦剂的种类对氟化物能否有效预防龋齿有较大影响。假如某含氟牙膏中使用的摩擦剂分可能为碳酸钙、水合硅石不溶于水且不与盐酸反应)中的一种或两种,而牙膏的其他成分均能溶于水且不与盐酸反应。请设计实验探究此牙膏中摩擦剂的成分。(写出实验思路即可) -
37. 科学学习小组同学在完成盐酸除铁锈实验时,发现生锈的铁钉表面有气泡生成。同学们对此现象感到很好奇,针对“气体是由什么反应生成的这”一问题,设计实验进行探究。
【设计实验】小组同学经过认真分析思考,提出了自己的假设,并设计了图甲所示的实验A和B进行探究。实验时,观察到试管A中有气泡,试管B中没有气泡,从而验证了自己的假设是成立的。
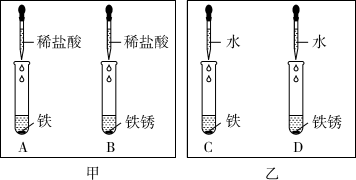 (1)、小组同学设计图甲所示实验基于的假设是;(2)、小金同学认为图甲实验A和B对照设置不够严谨,溶液中的水可能会对气体生成产生影响。于是在图甲实验基础上补充设计了如图乙对照实验C和D。但小科同学认为对照实验D的设置没有必要,他提出这一观点的理由是;(3)、【反思提高】设置对照实验首要问题是找准找全影响因素,通过控制变量,来进行对照实验的设置,实现对照实验组设置的有效性和完整性。
(1)、小组同学设计图甲所示实验基于的假设是;(2)、小金同学认为图甲实验A和B对照设置不够严谨,溶液中的水可能会对气体生成产生影响。于是在图甲实验基础上补充设计了如图乙对照实验C和D。但小科同学认为对照实验D的设置没有必要,他提出这一观点的理由是;(3)、【反思提高】设置对照实验首要问题是找准找全影响因素,通过控制变量,来进行对照实验的设置,实现对照实验组设置的有效性和完整性。【迁移应用】一次课外实验的意外现象:镁条放入Na2CO3溶液中,快速产生气泡。
请结合设置对照实验的思想,完成“气体是由什么反应生成的”问题探究。
【实验探究】查阅资料:①镁能与水缓慢反应生成氢气;②Na2CO3溶液呈碱性,其溶液中除了Na+、CO32-、水分子外,还有OH-。
小组同学设计了如图丙对照试验E、F和G。

往镁条中分别加入等量的水、Na2CO3溶液、x溶液进行实验。一段时间后,观察到试管E、G中有气体产生,但缓慢且少,试管F中产生气体既快又多。从对照实验设置的角度分析,实验G所加“x溶液”应该是;
(4)、分析图丙实验可知,镁条放入Na2CO3溶液中,气体是由镁与水反应生成的。试管F中快速产生气体,是因为Na2CO3溶液中存在能促进镁与水反应的离子,该离子是。 -
38. 思维模型的建构既方便于问题的解决,又能促进深度学习。某科学研究小组同学,在研究了气体检验专题内容后,认为气体检验的关键是干扰气体的界定,判断标准是对后续实验是否会产生干扰。于是在老师的指导下对解决“气体检验”类问题建构了如下思维模型:

【模型应用】同学们为检验天然气燃烧后的气体产物成分,应用思维模型设计了如图甲实验方案(固定装置未画出),将天然气在氧气中燃烧后得到的混合气体通过该方案进行实验。
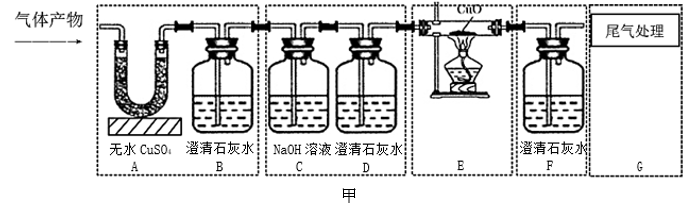 (1)、实验过程中观察到A装置中的无水硫酸铜变蓝,B、F装置中的澄清石灰水均变浑浊,D装置中的澄清石灰水不变浑浊,由此可得出该气体产物的成分为;(2)、图甲实验方案中,装置C和D归属于上述思维模型中的环节;(3)、【改进创新】小金同学认为,原气体产物中的CO2对CO的检验不会产生干扰,于是从简约装置、节约实验药品的角度出发,对图甲方案进行了改进与创新,去掉B、C、D装置,替换F、G装置,改用图乙所示的装置对该气体产物的成分进行探究。在实验中,小金先从A处通一段时间混合气体,再点燃E处酒精灯加热,观察现象,也实现了气体产物成分的检验。
(1)、实验过程中观察到A装置中的无水硫酸铜变蓝,B、F装置中的澄清石灰水均变浑浊,D装置中的澄清石灰水不变浑浊,由此可得出该气体产物的成分为;(2)、图甲实验方案中,装置C和D归属于上述思维模型中的环节;(3)、【改进创新】小金同学认为,原气体产物中的CO2对CO的检验不会产生干扰,于是从简约装置、节约实验药品的角度出发,对图甲方案进行了改进与创新,去掉B、C、D装置,替换F、G装置,改用图乙所示的装置对该气体产物的成分进行探究。在实验中,小金先从A处通一段时间混合气体,再点燃E处酒精灯加热,观察现象,也实现了气体产物成分的检验。
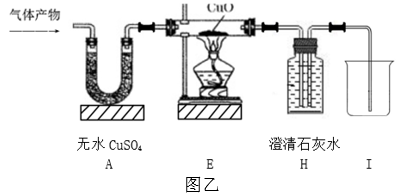
实验中,小金在加热前先通一段时间的混合气体,其目的是;(4)、实验中,判断E中玻璃管内空气已排净的实验现象是。 -
39. 酸碱理论的发展如下:
 (1)、根据朴素的酸碱理论,Na2CO3属于(选填“酸”或“碱”)。(2)、根据酸碱电离理论理解酸碱反应的实质是: 。(3)、已知H2CO3→ +H+和 →CO32-+H+ , 由酸碱质子理论,H2CO3的共轭碱是 。(4)、随着认知水平的不断提高,人们对酸碱理论的描述也在不断完善。下列对不同酸碱理论的分析合理的是 。A、酸碱电离理论认为酸碱是两种不同的物质 B、酸碱电离理论认为氧元素是酸中必不可少的元素 C、酸碱质子理论认为酸和碱可以是分子,也可以是离子 D、酸碱质子理论扩大了酸和碱的范围,不再具有局限性
(1)、根据朴素的酸碱理论,Na2CO3属于(选填“酸”或“碱”)。(2)、根据酸碱电离理论理解酸碱反应的实质是: 。(3)、已知H2CO3→ +H+和 →CO32-+H+ , 由酸碱质子理论,H2CO3的共轭碱是 。(4)、随着认知水平的不断提高,人们对酸碱理论的描述也在不断完善。下列对不同酸碱理论的分析合理的是 。A、酸碱电离理论认为酸碱是两种不同的物质 B、酸碱电离理论认为氧元素是酸中必不可少的元素 C、酸碱质子理论认为酸和碱可以是分子,也可以是离子 D、酸碱质子理论扩大了酸和碱的范围,不再具有局限性
五、综合说理题
-
40. 1823年德贝菜纳发现氢气在空气中遇到铂会起火,并研制出以他名字命名的世界上第一个化学打火机,如图甲所示。德贝菜纳打火机的结构如图所示。使用时,将顶盖上的开关打开,从内管中冲出的氢气贝点燃。开关关闭,喷嘴被堵住、火焰熄灭,随后氢气停止产生,请你用所学过的科学知识介绍德贝菜纳打火机的使用原理。

