山西省吕梁市交城县2021年中考化学二模试卷
试卷更新日期:2021-06-25 类型:中考模拟
一、单选题
-
1. 下列我国古代发明或技术中,主要原理不是化学变化的是( )A、炭黑制墨 B、粮食酿酒 C、胆矾炼铜 D、燃放烟火2. 人体缺碘会诱发的疾病是( )A、癌症 B、夜盲症 C、坏血病 D、甲状腺肿大3. 某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
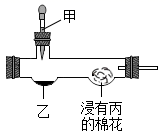
选项
甲
乙
丙
A
浓氨水
\
无色酚酞溶液
B
石灰水
碳酸钠
无色酚酞溶液
C
稀盐酸
石灰石
紫色石蕊溶液
D
浓盐酸
锌粒
紫色石蕊溶液
A、A B、B C、C D、D4. 硒元素具有抗衰老、抑制癌细胞生长的功能,其原子结构示意图及在元素周期表中的信息如图,下列说法错误的是()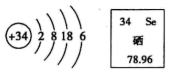 A、硒原子核内有34个质子 B、硒元素的相对原子质量是78.96g C、硒元素位于元素周期表中第四周期 D、硒元素在某些化合物中可显-2价5. 下列总结的化学知识有错误的一组是;( )
A、硒原子核内有34个质子 B、硒元素的相对原子质量是78.96g C、硒元素位于元素周期表中第四周期 D、硒元素在某些化合物中可显-2价5. 下列总结的化学知识有错误的一组是;( )A.安全常识
B.生活知识
瓦斯爆炸﹣甲烷引起
假酒中毒﹣甲醇引起
煤气中毒﹣一氧化碳引起
爱护水资源﹣节约用水和防止水污染
湿衣服晾干﹣分子在不断的运动
活性炭净水﹣吸附作用
C.物质的性质与用途
D.元素与人体健康
氢气作高能燃料﹣可燃性
用墨书写字画﹣稳定性
浓硫酸作干燥剂﹣脱水性
缺铁﹣贫血
缺钙﹣骨质疏松
缺氟﹣龋齿
A、A B、B C、C D、D6. 下列物质分类正确的是( )A、石油、煤、氢气—一化石燃料 B、过氧化氢、二氧化硅、臭氧——氧化物 C、HNO3、H2SO4、CH3COOH——酸 D、干冰、葡萄糖、蛋白质——有机物7. 20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )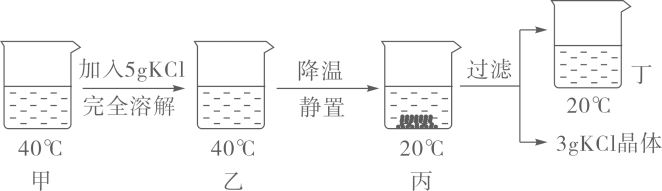 A、甲烧杯中是KCl的饱和溶液 B、乙和丙烧杯中KCl的质量分数相等 C、丁烧杯中KCl的质量分数为34% D、若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g8. 一定温度下,向不饱和的氯化铜溶液中加入足量的下列固体,其对应关系正确的是( )A、
A、甲烧杯中是KCl的饱和溶液 B、乙和丙烧杯中KCl的质量分数相等 C、丁烧杯中KCl的质量分数为34% D、若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g8. 一定温度下,向不饱和的氯化铜溶液中加入足量的下列固体,其对应关系正确的是( )A、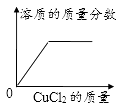 B、
B、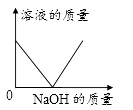 C、
C、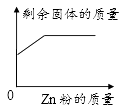 D、
D、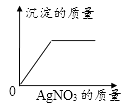 9. 从下图某化学反应的微观示意图中,获得的信息错误的是( )
9. 从下图某化学反应的微观示意图中,获得的信息错误的是( )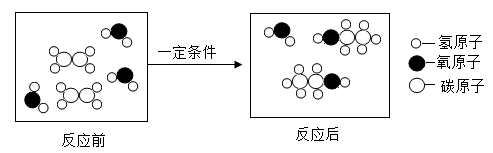 A、参加反应的一种物质的化学式为C2H4 B、该反应的生成物为混合物 C、参加反应的两种物质的分子个数比为1:1 D、
A、参加反应的一种物质的化学式为C2H4 B、该反应的生成物为混合物 C、参加反应的两种物质的分子个数比为1:1 D、 中碳、氢、氧原子个数比为2:6:1
10. 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
中碳、氢、氧原子个数比为2:6:1
10. 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是( )
A、步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗 B、溶液A中溶质是H2SO4、CuSO4 C、上述流程中物质B是锌,物质D是盐酸 D、A~E中都含有铜、锌两种元素的物质有A和C二、填空题
-
11. “新冠肺炎”疫情防控是一项长期的工作,不能松懈。(1)、一次性医用口罩阻隔病毒的关键材料熔喷布,是以聚丙烯为原料生产的。聚丙烯属于(填“合成”或“复合”)材料。(2)、测量体温时,水银温度计的汞柱会升高。请从微观角度解释汞柱升高的原因:温度升高,。12. 妈妈为小鹏准备了一份午餐:米饭、红烧肉、糖醋鱼、咸鸭蛋、豆腐汤、酸奶。请回答下列问题:(1)、为保证各种营养素的均衡摄入,午餐中还应补充的营养素是。(2)、午饭后,小鹏感到胃不舒服,服用含氢氧化铝的药物中和过多的胃酸,症状有所缓解。写出该反应的化学方程式。13. 某工业园区甲、乙两化工厂排放的废水中含有K+、 Cu2+、Fe3+、Cl- 、OH-、NO3-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来产重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水星碱性。(1)、甲厂废水中定含有的离子是 , 可能含有的离子是;(2)、经课外实践小组多次实验,发现两厂废水按适当比例混合,可将废水中的某些离子转化为沉淀,这些离子分别是(填离子符号),过滤后的废水中主要含有两种物质(填化学式),处理后的废水符合排放标准。
三、计算题
-
14. 屠呦呦因创制新型抗疟药——青蒿素和双氢青蒿素而获得诺贝尔奖。青蒿素的相对分子质量为282,每个分子由15个碳原子、5个氧原子和n个氢原子构成。请计算:(1)、n为。(2)、28.2g青蒿素中氧元素的质量为g。15. 某化工厂的废水中含少量氢氧化钠,技术人员欲测其含量。取废水20g,向其中逐滴滴加9.8%的稀硫酸,利用pH传感器测定溶液pH变化如下图所示。通过计算判断该废水是否可以直接排放?(排放标准:废水中氢氧化钠的质量分数<0.001%)

四、综合题
-
16. 硬水不仅对健康造成危害,而且会给生活带来很多麻烦。硬水受热后会产生水垢,水垢的主要成分是碳酸钙和氢氧化镁,其他成分不参与反应,实验室由水垢制取纯净氯化钙固体的流程如下:

请按要求填空:
(1)、用区别硬水和软水。(2)、步骤②中加的碱的化学式是;步骤③过滤操作中用到玻璃棒的作用是。(3)、步骤④中加入适量稀盐酸的目的是 , 若盐酸过量对氯化钙固体的纯度(选填“有”或“无”)影响。17. 阅读下面科普短文人类目前所消耗的能量主要来自于化石能源,化石燃料是由古代生物的遗骸经过一系列复杂的变化形成的。化石燃料燃烧时产生的一些物质。如一氧化碳、二氧化硫、未燃烧的碳氢化合物及碳粒、氮的氧化物等排放到空气中,会对空气造成污染。二氧化硫和氮的氧化物在空气中发生反应后的生成物溶于雨水,会形成酸雨。天然气是一种重要的化石燃料,主要含有碳和氢组成的碳氢化合物,其中最主要的是甲烷。不同地区天然气的主要成分有较大差异,我国部分地区天然气的主要成分如下表所示:
CH4
C2H6
C3H8
CO2
N2
H2S
西南油田
93.1098
3.8914
0.1447
1.3092
0.5341
—
华北油田
80.8430
9.7326
5.7538
0.9288
0.3200
—
陕甘宁油田
95.9500
0.9675
0.1367
1.5038
—
0.0002
注:1.表中数据均表示体积分数。2.“—”表示含量过低,当前所用仪器未检出。
天然气的用途非常广泛,可作为燃料直接使用。天然气在不同设备中燃烧产生的污染物的含量也不尽相同,几种常见设备中天然气燃烧时产生的污染物(kg/Mm3)如图所示:

现代社会对能量的需要量越来越大,化石燃料日渐枯竭,人们正在利用和开发其他能源。这些能源的利用,可以部分解决化石燃料面临耗尽的问题,并一定程度减少了对环境的污染。
依据文章内容,回答下列问题。
(1)、化石燃料是(填“可再生”或“不可再生”)能源。(2)、油田的天然气中丙烷(C3H8)含量最高。(3)、氮的氧化物排放到空气中可形成酸雨,酸雨是pH<的降雨。酸雨会使土壤酸化,能不能氢氧化钠改良酸性土壤?(填“能”或“不能”)(4)、在电厂、工业锅炉和民用采暖设备中天然气燃烧效率最低的是。A 电厂 B 工业锅炉 C 民用采暖设备
18. A、B、C、E、F分别为单质、氧化物、酸、碱、盐五种物质类别中的一种常见物质,已知A是最常用的溶剂,E俗称纯碱。它们之间相互关系如图所示,图中“一”表示相连的物质能相互反应,“→”表示一种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)。请回答下列问题: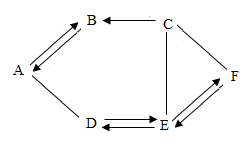 (1)、物质A是。(2)、写出下列反应的化学方程式:A→B:;E→F。(3)、图中反应涉及的基本反应类型最多有种。19. 利用下列装置进行气体的制取实验,请问答下列问题:
(1)、物质A是。(2)、写出下列反应的化学方程式:A→B:;E→F。(3)、图中反应涉及的基本反应类型最多有种。19. 利用下列装置进行气体的制取实验,请问答下列问题: (1)、写出仪器的名称:①②。(2)、实验室用过氧化氯溶液制取氧气时,若要制取一瓶干燥的氧气,必须使气体通过(填字母,下同)装置,选用装置收集,验满的方法是。(3)、实验室用加热高锰酸钾固体的方法制取较纯净的氧气,选用发生装置和收集装置G组合,检查该装置气密性的方法是:连接好仪器,把导管的一端浸入水中, , 证明装置连接完好、不漏气。(4)、实验室用电石固体与饱和食盐水常温下反应制取乙炔(C2H2)气体,发生装置选用C而不选用B的原因是。写出食盐的一种用途。20. 某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。(1)、(查阅资料)氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式。(2)、(提出问题)滤液中溶质的成分是什么?
(1)、写出仪器的名称:①②。(2)、实验室用过氧化氯溶液制取氧气时,若要制取一瓶干燥的氧气,必须使气体通过(填字母,下同)装置,选用装置收集,验满的方法是。(3)、实验室用加热高锰酸钾固体的方法制取较纯净的氧气,选用发生装置和收集装置G组合,检查该装置气密性的方法是:连接好仪器,把导管的一端浸入水中, , 证明装置连接完好、不漏气。(4)、实验室用电石固体与饱和食盐水常温下反应制取乙炔(C2H2)气体,发生装置选用C而不选用B的原因是。写出食盐的一种用途。20. 某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。(1)、(查阅资料)氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式。(2)、(提出问题)滤液中溶质的成分是什么?(猜想假设)猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和。
猜想四:NaOH、Na2CO3和Ca(OH)2
(3)、(讨论分析)经过讨论认为最不合理的是猜想。(4)、(实验与结论)实验步骤
现象
结论
步骤I:取少量滤液,向其中加入足量盐酸溶液
猜想二不成立
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液
产生白色沉淀
猜想成立
(5)、(拓展延伸)在分析反应后所得物质的成分时,除考虑生成物外,还需考虑。