浙教版科学八年级上册 第一章6、7节同步练习
试卷更新日期:2021-06-23 类型:同步测试
一、单选题
-
1.
20℃时100g某硝酸钾溶液,经过以下变化,恢复到20℃,最终析出晶体的质量是( )
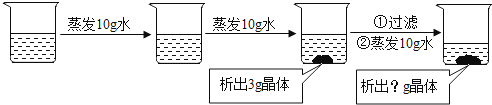 A、小于3克 B、等于3克 C、大于3克 D、大于等于3克2.
A、小于3克 B、等于3克 C、大于3克 D、大于等于3克2.如图是甲、乙、丙三种物质的溶解度曲线.下列说法错误的是( )
 A、t1℃时,三种物质的溶解度是丙>乙>甲 B、t2℃时,甲和丙的饱和溶液溶质质量分数相等 C、三种物质的溶解度均随温度的升高而增大 D、当甲中混有少量的乙时可用冷却其热饱和溶液的方法提纯3.
A、t1℃时,三种物质的溶解度是丙>乙>甲 B、t2℃时,甲和丙的饱和溶液溶质质量分数相等 C、三种物质的溶解度均随温度的升高而增大 D、当甲中混有少量的乙时可用冷却其热饱和溶液的方法提纯3.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
 A、t1℃时,甲、乙两种物质的饱和溶液中溶质的质量相等 B、将甲、乙的饱和溶液从t2℃降到t1℃,两者均有晶体析出 C、将甲的溶液从t1℃升到t2℃,其溶质的质量分数一定增大 D、当温度高于t1℃而低于t2℃时,乙的溶解度比甲的溶解度小4.
A、t1℃时,甲、乙两种物质的饱和溶液中溶质的质量相等 B、将甲、乙的饱和溶液从t2℃降到t1℃,两者均有晶体析出 C、将甲的溶液从t1℃升到t2℃,其溶质的质量分数一定增大 D、当温度高于t1℃而低于t2℃时,乙的溶解度比甲的溶解度小4.如图是甲和乙的溶解度曲线.下列说法中正确的( )
 A、甲的溶解度大于乙的溶解度 B、乙的溶解度不受温度的影响 C、t1℃时,甲的饱和溶液升温到t2℃时(不考虑水分的蒸发)会有晶体析出 D、t2℃时,甲与乙的溶解度相等5. t℃时,将一定量的某物质的溶液分成三等份,分别加热,再降温到t℃。已知从三份溶液中蒸发掉的溶剂分别为10克、20克、30克,析出的晶体分别为a克、b克、c克,则“a、b、c三者关系为 ( )A、c=a+b B、c=a+2b C、c=2a+b D、c=2b-a6. 下表是不同温度时NaCl、KNO3的溶解度.则下列说法正确的是( )
A、甲的溶解度大于乙的溶解度 B、乙的溶解度不受温度的影响 C、t1℃时,甲的饱和溶液升温到t2℃时(不考虑水分的蒸发)会有晶体析出 D、t2℃时,甲与乙的溶解度相等5. t℃时,将一定量的某物质的溶液分成三等份,分别加热,再降温到t℃。已知从三份溶液中蒸发掉的溶剂分别为10克、20克、30克,析出的晶体分别为a克、b克、c克,则“a、b、c三者关系为 ( )A、c=a+b B、c=a+2b C、c=2a+b D、c=2b-a6. 下表是不同温度时NaCl、KNO3的溶解度.则下列说法正确的是( )温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
KNO3
13.3
31.6
63.9
110
169
A、将60℃时KNO3的饱和溶液降温至20℃,溶质、溶剂的质量都会减少 B、将80℃时NaCl、KNO3两种饱和溶液降温至20℃,析出晶体的质量一定是:KNO3>NaCl C、40℃时,将5g NaCl、5g KNO3分别加入10g水中,所得溶液的溶质质量分数不相等 D、用上表数据绘制成NaCl、KNO3的溶解度曲线,两条曲线交点对应的温度范围是0~20℃7.图1是甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )
 A、甲物质的溶解度比乙物质的溶解度大 B、加入试管1的固体是丙 C、向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出 D、将30℃时甲、乙、丙三种物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙8.
A、甲物质的溶解度比乙物质的溶解度大 B、加入试管1的固体是丙 C、向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出 D、将30℃时甲、乙、丙三种物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙8.如图是A、B、C三种固体(都不含结晶水)物质的溶解度曲线.下列说法或判断中正确的是( )
 A、t1℃时,A、B、C三种物质的溶解度由大到小的顺序为B>A>C B、t1℃时将10g A物质放入50g水中,充分搅拌所得溶液的质量为60g C、若B物质是氯化钠,可用冷却热饱和溶液结晶的方法获得大量的氯化钠晶体 D、将t2℃时的三种物质的饱和溶液分别降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是B>A>C9. 将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列相关量随时间变化趋势的图象不.正.确.的是( )A、
A、t1℃时,A、B、C三种物质的溶解度由大到小的顺序为B>A>C B、t1℃时将10g A物质放入50g水中,充分搅拌所得溶液的质量为60g C、若B物质是氯化钠,可用冷却热饱和溶液结晶的方法获得大量的氯化钠晶体 D、将t2℃时的三种物质的饱和溶液分别降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是B>A>C9. 将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列相关量随时间变化趋势的图象不.正.确.的是( )A、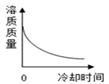 B、
B、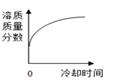 C、
C、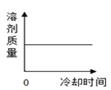 D、
D、 10.
10.右图所示是a、b、c(不含结晶水)三种固体物质的溶解度曲线,下列说法正确的是( )
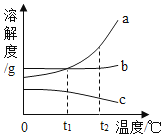 A、三种物质溶解度的大小顺序是a>b>c B、t2℃时,将a的溶液降温至t1℃,可能有晶体析出 C、t1℃时,a、b两种物质的溶液中溶质质量分数一定相等 D、采用升高温度的方法,可将饱和的c物质溶液变成不饱和11.
A、三种物质溶解度的大小顺序是a>b>c B、t2℃时,将a的溶液降温至t1℃,可能有晶体析出 C、t1℃时,a、b两种物质的溶液中溶质质量分数一定相等 D、采用升高温度的方法,可将饱和的c物质溶液变成不饱和11.某校科学兴趣小组的同学想要了解工厂排放的废水对河流水质的影响。图中表示了7个可能的水样采集点(箭头表示水流方向),其中最重要的采集点是()
 A、①③④⑦ B、①②⑤⑦ C、②③④⑥ D、②⑤⑥⑦12.
A、①③④⑦ B、①②⑤⑦ C、②③④⑥ D、②⑤⑥⑦12.地球所有的水资源都汇集到一起也只能形成一滴直径约1384千米的水珠,如图。保护水资源是每个地球公民应尽之责,下列做法正确的是( )
 A、填湖造房 B、分类处理生活污水 C、直接排放工业废水 D、过量施用农药化肥13. 导致我国水资源紧张的人为原因主要有( )
A、填湖造房 B、分类处理生活污水 C、直接排放工业废水 D、过量施用农药化肥13. 导致我国水资源紧张的人为原因主要有( )①水资源数量本身有限 ②水资源季节分配不均,年际变化大 ③随着人口的增加以及工农业的飞速发展,水资源需求量大增 ④工农业生产和日常生活对水资源污染严重 ⑤存在着较为普遍的浪费现象
A、①②③ B、②③④ C、③④⑤ D、①②⑤14.南水北调工程连接的四大流域是( )
 A、长江、黄河、海河、辽河 B、长江、淮河、黄河、海河 C、长江、珠江、辽河、黄河 D、长江、黄河、淮河、金沙江15. 在粗盐提纯的实验中,下列操作正确的是( )A、粗盐称量
A、长江、黄河、海河、辽河 B、长江、淮河、黄河、海河 C、长江、珠江、辽河、黄河 D、长江、黄河、淮河、金沙江15. 在粗盐提纯的实验中,下列操作正确的是( )A、粗盐称量 B、粗盐溶解
B、粗盐溶解  C、浊液过滤
C、浊液过滤  D、蒸发结晶
D、蒸发结晶 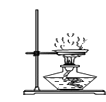 16. 2015年“世界水日”的宣传主题是“水与可持续发展”.下列有关水的说法正确的是( )
16. 2015年“世界水日”的宣传主题是“水与可持续发展”.下列有关水的说法正确的是( )
A、水可用于灭火 B、淡水资源是取之不尽,用之不竭的 C、可用紫色石蕊试液区分硬水和软水 D、海洋有自净能力,所以不存在海水污染问题17. 由混有少量硝酸钾的食盐晶体,提取较纯的食盐,可供选择的实验步骤和结论有:①在较高的温度下制成该晶体的饱和溶液;②在常温下制成该晶体的饱和溶液;③升高溶液温度不断蒸发水分,直到大量固体析出;④降温至有较多量晶体析出;⑤过滤;⑥得到的晶体即是较纯的食盐。正确的操作步骤和结论是( )
A、①④⑤⑥ B、①④⑥ C、②③⑥ D、②③⑤⑥18. 如图所示的化学实验基本操作中,正确的是( )A、 过滤
B、
过滤
B、 量取液体
C、
量取液体
C、 点燃酒精灯
D、
点燃酒精灯
D、 滴加液体
19. 如图所示实验操作正确的是( )A、
滴加液体
19. 如图所示实验操作正确的是( )A、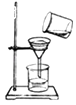 过滤
B、
过滤
B、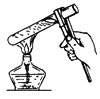 加热液体
C、
加热液体
C、 制取氢气
D、
制取氢气
D、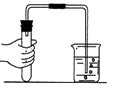 检查装置气密性
20. 在一定温度下,向15g蒸馏水加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色晶体和8.4g滤液,若此温度下无水硫酸铜的溶解度为40g,则此无水硫酸铜的质量是( )A、6.6g B、9g C、18.4g D、16g
检查装置气密性
20. 在一定温度下,向15g蒸馏水加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色晶体和8.4g滤液,若此温度下无水硫酸铜的溶解度为40g,则此无水硫酸铜的质量是( )A、6.6g B、9g C、18.4g D、16g二、填空题
-
21.
如图是A,B,C三种固体物质的溶解度曲线,请回答下列问题:
(1)P点的含义是 ;
(2)若B点混有少量A时,可采用的方法提纯B;
(3)t1℃时,能不能配制溶质的质量分数为40%的C溶液? (填“能”或“不能”);
(4)t2℃时,将A,B,C三种固体物质各30g加入到100g水中,充分溶解,形成不饱和溶液的是 ;
(5)将t1℃时A,B,C三种固体物质的饱和溶液升温到t2℃,其溶质的质量分数由大到小的顺序是 .
 22.
22.Na2SO4是制造纸张、药品、染料稀释剂等的重要原料.某Na2SO4样品中含有少量CaCl2和MgCl2 , 实验室提纯Na2SO4的流程如图1所示

(1)加入Na2CO3溶液可除去的阳离子是 (填离子符号),其反应的化学方程式为: .若添加的NaOH溶液和Na2CO3溶液过量,可加入适量 (填名称)除去.
(2)操作a的名称是 ,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、 .
(3)溶液M中的溶质是Na2SO4和杂质NaCl,观察图2中溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤.降温结晶的最佳温度范围是 ℃以下,因为Na2SO4溶解度 .
 23.
23.如图是A、B、C(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题.
(1)在40℃时,A、B、C三种物质的溶解度由大到小的关系是 (物质间用“>”连接);
(2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是: (物质间用“<”连接);
(3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发10克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是: .
 24. 读“水循环示意图”,回答下列问题.
24. 读“水循环示意图”,回答下列问题. (1)、写出图中各代号所代表的水循环的环节名称
(1)、写出图中各代号所代表的水循环的环节名称ABCD F
(2)、按照水循环发生领域的可划分为三种类型,其中,水循环总量最大的是循环.25. 如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答: (1)、写出标号仪器的名称:A , D .(2)、图中还缺少的一种仪器是 , 其作用是 , 装置安装存在一处的错误是 , 这样安装会出现的后果是 .(3)、在过滤时,若经过两次过滤后滤液仍然浑浊,其原因可能是 , (要求写出两条).26. 学校科学兴趣小组在讨论“水”的话题,大家积极参与,话题如下:(1)、如图,自然界中的水通过蒸发、降水、渗透、地表径流等环节进行着持续不断的循环。 其中“南水北调”工程对我国水资源“南方多,北方少”的状况有所改善。“南水北调”工程改变水循环中的环节是(填序号)
(1)、写出标号仪器的名称:A , D .(2)、图中还缺少的一种仪器是 , 其作用是 , 装置安装存在一处的错误是 , 这样安装会出现的后果是 .(3)、在过滤时,若经过两次过滤后滤液仍然浑浊,其原因可能是 , (要求写出两条).26. 学校科学兴趣小组在讨论“水”的话题,大家积极参与,话题如下:(1)、如图,自然界中的水通过蒸发、降水、渗透、地表径流等环节进行着持续不断的循环。 其中“南水北调”工程对我国水资源“南方多,北方少”的状况有所改善。“南水北调”工程改变水循环中的环节是(填序号) (2)、能确认水是由氢元素和氧元素组成的实验是 ;A、水的蒸发 B、水的电解 C、水的净化 D、水的蒸馏(3)、某同学发现最近家里的自来水有点浑浊,就想着自制一个如图所示的简易净水器。该净化过程中,用到分离混合物的方法有等(填一个即可)。通过这个简易装置净化后的水还是不能直接饮用,原因是。
(2)、能确认水是由氢元素和氧元素组成的实验是 ;A、水的蒸发 B、水的电解 C、水的净化 D、水的蒸馏(3)、某同学发现最近家里的自来水有点浑浊,就想着自制一个如图所示的简易净水器。该净化过程中,用到分离混合物的方法有等(填一个即可)。通过这个简易装置净化后的水还是不能直接饮用,原因是。
三、实验探究题
-
27. 某科学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50克20%的氯化钠溶液。请回答下列有关问题:(1)、实验一:下图是同学们做粗盐提纯实验的操作示意图。
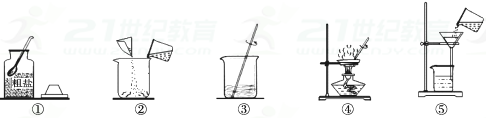
a.实验操作有错误的步骤是;
b.步骤③中玻璃棒的作用是;
(2)、实验二:用粗盐提纯后得到的精盐配制了氯化钠溶液,经检测,溶质质量分数偏小。其原因可能有 (填字母序号)。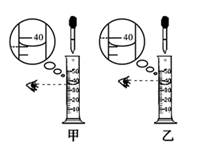 A、氯化钠固体仍然不纯 B、称量时只在天平左盘垫上滤纸 C、配制好的氯化钠溶液装瓶时,有少量溶液洒出 D、称量时使用了生锈的砝码 E、用量筒量取水时,仰视读数(3)、实验三:在溶液配制过程中,若要用量筒量取40毫升的水,当液面接近刻度线时,要改用胶头滴管,在用滴管滴加水的过程中,眼睛视线应同时按图进行观察。
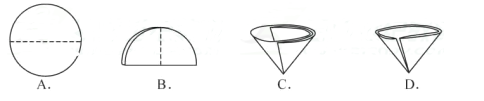
A、氯化钠固体仍然不纯 B、称量时只在天平左盘垫上滤纸 C、配制好的氯化钠溶液装瓶时,有少量溶液洒出 D、称量时使用了生锈的砝码 E、用量筒量取水时,仰视读数(3)、实验三:在溶液配制过程中,若要用量筒量取40毫升的水,当液面接近刻度线时,要改用胶头滴管,在用滴管滴加水的过程中,眼睛视线应同时按图进行观察。实验四:操作⑤中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。
 28. 某科学兴趣小组的同学做粗盐(含有不溶性杂质)提纯实验,并用所得精盐配置50克5%的氧化钠溶液。
28. 某科学兴趣小组的同学做粗盐(含有不溶性杂质)提纯实验,并用所得精盐配置50克5%的氧化钠溶液。 (1)、实验一:如图是同学们做粗盐提纯实验的操作示意图。回答下列问题:
(1)、实验一:如图是同学们做粗盐提纯实验的操作示意图。回答下列问题:a.粗盐提纯实验的操作顺序为(填上述操作序号次序);
b.经操作⑥后滤液仍浑浊,原因可能是(答出一点即可);
c.④步骤中的玻璃棒有作用。
(2)、实验二:用提纯得到的精盐配制50克5%的氯化钠溶液。步骤如下:a、计算:可计算出需精盐克,需水毫升。
b.称量和量取:称量氯化钠时,若发现天平指针向左偏,则应怎么处理?。
C.溶解:经检测,所配制的氯化钠溶液的溶质质量分数偏小,其可能原因是。
A.所用的氯化钠固体中含有杂质
B.量取水时,仰视读数
C.将水倒入烧杯时,有少量水溅出
D.将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上
E.将配制好的溶液转移进试剂瓶时,有溶液洒落
29. 氯化钠是生活必需品,也是重要的化工原料。兴趣小组提纯含少量泥沙等杂质的粗盐,操作流程如下: (1)、操作④的名称是。(2)、操作⑤中除用到铁架台、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器有。(3)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是。
(1)、操作④的名称是。(2)、操作⑤中除用到铁架台、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器有。(3)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是。A.食盐没有全部溶解即过滤 B.过滤后滤液仍然浑浊就蒸发结晶
C.蒸发后,所得精盐很潮湿 D.称量最终的产品时,器皿上沾有的精盐没全部转移到天平上
(4)、通过操作④得到澄清透明的液体,并蒸发得到精盐(晶体表面无水分)。小组同学兴奋地宣布:我终于制得了纯净的氯化钠!对此.你同意这个看法吗?请说明理由。30.工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
物质
K2CO3
K2SO4
KMnO4
溶解度/g
111
11.1
6.34
(1)、KMnO4中锰元素的化合价为 .(2)、操作Ⅰ的名称是 .“干燥”过程中温度不宜过高的原因是 (用化学方程式表示).(3)、“通CO2酸化”,反应的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2↓十2K2CO3 ,若用稀H2SO4酸化,反应的化学方程式为:
3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O
工业上不采用稀H2SO4酸化的原因是 .
(4)、电解法也可以实现由向K2MnO4向KMnO4的转化,反应的化学方程式为:
2K2MnO4+2H2O
 2KMnO4+2KOH十H2↑
2KMnO4+2KOH十H2↑与“通CO2酸化”相比,其优点是 .
31.在实验室可用如图装置制取蒸馏水.回答下列问题:
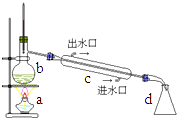 (1)、写出装置图中仪器的名称:
(1)、写出装置图中仪器的名称:B;c;d
(2)、仪器C的作用是;冷水由端流入,由端流出;(3)、水在中由液态变气态,在中由气态变为液态.32.如图所示,实验Ⅰ是制备蒸馏水的装置,实验Ⅱ是电解水的装置.
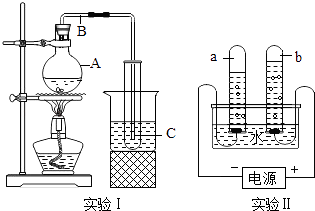 (1)、实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的 .(2)、实验Ⅱ间隔中发生了化学反应为 , b试管中产生的气体可以用检验.当b中产生10mL气体时,则a中产生的气体体积是;它们的质量比是 .(3)、点燃a中气体时,观察到的现象是 . 该实验能够说明:水是由组成的,一个水分子由构成.(4)、下列变化中,能用来确定水的组成的是 .A、H2和O2反应 B、电解水 C、Na和Cl2反应 D、酒精燃烧.(5)、“世界上最后一滴水就是人类的眼泪”.这句话警示我们要树立保护水资源的意识:一是 , 二是 .
(1)、实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的 .(2)、实验Ⅱ间隔中发生了化学反应为 , b试管中产生的气体可以用检验.当b中产生10mL气体时,则a中产生的气体体积是;它们的质量比是 .(3)、点燃a中气体时,观察到的现象是 . 该实验能够说明:水是由组成的,一个水分子由构成.(4)、下列变化中,能用来确定水的组成的是 .A、H2和O2反应 B、电解水 C、Na和Cl2反应 D、酒精燃烧.(5)、“世界上最后一滴水就是人类的眼泪”.这句话警示我们要树立保护水资源的意识:一是 , 二是 .四、解答题
-
33. 根据图 A、B、C 三种固体的溶解度曲线回答:
 (1)、在某一温度时,A、B 两饱和溶液的溶质质量分数相等,此时为℃。(2)、在 t1℃~t2℃范围内,A、B、C 三种物质的溶解度由大到小的顺序为。(3)、要使 C 的饱和溶液变为不饱和溶液,可采用的一种方法是。(4)、要从含有少量 A 的 B 溶液中得到较多的 B 晶体,通常采用的方法是。(5)、t3℃时,将 30gA 加入到装有 50g 水的烧杯中,充分搅拌,所得溶液的溶质质量分数为(结果精确至 0.1%)。(6)、在室温时将 A 物质加入到盛水的烧杯中,充分搅拌后发现仍有少量 A 未溶解,但放置一段时间后,发现 A 完全溶解了,可能的原因是。34. 100 g40%的氯化铵不饱和溶液,从50℃降温至10℃时,溶质的质量分数变为25%.问:
(1)、在某一温度时,A、B 两饱和溶液的溶质质量分数相等,此时为℃。(2)、在 t1℃~t2℃范围内,A、B、C 三种物质的溶解度由大到小的顺序为。(3)、要使 C 的饱和溶液变为不饱和溶液,可采用的一种方法是。(4)、要从含有少量 A 的 B 溶液中得到较多的 B 晶体,通常采用的方法是。(5)、t3℃时,将 30gA 加入到装有 50g 水的烧杯中,充分搅拌,所得溶液的溶质质量分数为(结果精确至 0.1%)。(6)、在室温时将 A 物质加入到盛水的烧杯中,充分搅拌后发现仍有少量 A 未溶解,但放置一段时间后,发现 A 完全溶解了,可能的原因是。34. 100 g40%的氯化铵不饱和溶液,从50℃降温至10℃时,溶质的质量分数变为25%.问:从50℃降至10℃的过程中有无氯化铵晶体析出?若能析出晶体,则析出晶体质量为多少?
35.1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
②2NaHCO3
 Na2CO3+H2O+CO2↑(1)、侯氏制碱法所制的“碱”是指 .(2)、工业生产过程中,铵盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是晶体(填物质名称).(3)、
Na2CO3+H2O+CO2↑(1)、侯氏制碱法所制的“碱”是指 .(2)、工业生产过程中,铵盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是晶体(填物质名称).(3)、现有Na2CO3和NaCl的混合样品22.3g,将其放入干净的烧杯中,加一定质量的水使其完全溶解,向所得溶液中逐渐加入溶质质量分数为7.3%的稀盐酸烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示,试回答下列问题:
①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为 (写化学式).
②在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为 g.
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量 (计算结果精确至0.1g)
 36.
36.海洋是丰富的化学资源宝库.通过晾晒海水,可以得到含少量泥沙的粗盐.用来得到纯净的盐(不考虑可溶性杂质),设计了如图所示的实验操作:
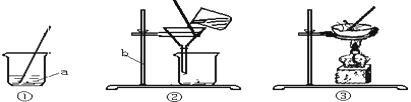 (1)、上图有标号的仪器名称分别是a , b .(2)、操作②的名称是 , 玻璃棒的作用是 .(3)、操作③中看到时,停止加热.37. 为了探究“水的净化”过程,某科学实验小组从护城河中取了水样,观察到:A.水样呈黄色,有异味;B.水样浑浊,有固体小颗粒。现对水样进行如下处理:(1)、①向水样中加入明矾搅拌溶解,静置一段时间后,进行 (填操作名称),除去固体小颗粒,再向滤液中加入活性炭,利用其 性除去水样中的颜色和异味,该过程属于 (填“物理”或“化学”)变化。
(1)、上图有标号的仪器名称分别是a , b .(2)、操作②的名称是 , 玻璃棒的作用是 .(3)、操作③中看到时,停止加热.37. 为了探究“水的净化”过程,某科学实验小组从护城河中取了水样,观察到:A.水样呈黄色,有异味;B.水样浑浊,有固体小颗粒。现对水样进行如下处理:(1)、①向水样中加入明矾搅拌溶解,静置一段时间后,进行 (填操作名称),除去固体小颗粒,再向滤液中加入活性炭,利用其 性除去水样中的颜色和异味,该过程属于 (填“物理”或“化学”)变化。②将自来水蒸馏得到纯净水,把下列物质分别加入纯净水中,用玻璃棒不断搅拌,能形
成无色溶液的是 (填字母)。
A.粉笔灰 B.硫酸铜
C.蔗糖 D.食用油
(2)、天然水中含有许多杂质,实验室常用过滤的方法除去水中悬浮的杂质,过滤需要用到的仪器和用品有 (填序号)。①带铁圈的铁架台 ②酒精灯 ③漏斗 ④玻璃棒 ⑤量筒 ⑥烧杯 ⑦滤纸
利用蒸发原理可以从海水中提取食盐,仅从①~⑦中选择仪器不能完成实验室蒸发食盐水的实验,还需要的仪器是 。