浙教版科学八年级上册第一章 第4、5节同步训练
试卷更新日期:2021-06-23 类型:同步测试
一、单选题
-
1. 如图所示是甲、乙两种物质的溶解度曲线。将t2℃时等质量的甲、乙两种物质的饱和溶液降温到t1 ℃时( )
 A、两种溶液仍是饱和溶液 B、两种溶液的质量仍相同 C、乙溶液的溶质质量分数比甲大 D、乙溶液中溶剂的质量比甲多2. 配制硝酸钾溶液时得到下表数据。根据表中数据分析,不正确的是( )
A、两种溶液仍是饱和溶液 B、两种溶液的质量仍相同 C、乙溶液的溶质质量分数比甲大 D、乙溶液中溶剂的质量比甲多2. 配制硝酸钾溶液时得到下表数据。根据表中数据分析,不正确的是( )序号
温度/℃
水的质量/克
所加硝酸钾的质量/克
所得溶液的质量/克
①
28
10
4
14
②
28
10
6
14
③
60
10
8
18
A、28℃时10克水中最多能溶解硝酸钾4克 B、60℃时等质量水中能溶解的硝酸钾比28℃时多 C、①②所得溶液溶质的质量分数相等 D、③所得溶液一定是硝酸钾的饱和溶液3. 如图,是A、B两种物质的溶解度曲线。下列说法正确的是( ) A、t℃时A物质饱和溶液的溶质质量分数为40% B、t℃时B物质的饱和溶液降温后仍然饱和 C、B物质的溶解度受温度的影响更大 D、A物质的溶解度大于B物质4.
A、t℃时A物质饱和溶液的溶质质量分数为40% B、t℃时B物质的饱和溶液降温后仍然饱和 C、B物质的溶解度受温度的影响更大 D、A物质的溶解度大于B物质4.周末,感到有点饿的甲同学泡了一杯白糖开水,他用筷子充分搅拌杯中的白糖后,将杯子放在一边待糖水变凉,喝糖水时,发现杯底有少量未溶解的白糖(如图所示)。下列操作或现象能说明糖水一定属于饱和溶液的是( )
 A、泡糖水时进行了充分搅拌 B、糖水热的时候白糖全部溶解 C、凉的糖水 底部有剩余的白糖 D、喝糖水时感到很甜5.
A、泡糖水时进行了充分搅拌 B、糖水热的时候白糖全部溶解 C、凉的糖水 底部有剩余的白糖 D、喝糖水时感到很甜5.右图是甲、乙两种固体物质的溶解度曲线。若分别将100克甲、乙饱和溶液的温度从t2℃降至t1℃,对所得溶液的叙述正确的是( )
 A、两溶液都仍为饱和溶液 B、两物质的溶解度:甲>乙 C、两溶液的质量:甲<乙 D、两溶液溶质的质量分数:甲>乙6.
A、两溶液都仍为饱和溶液 B、两物质的溶解度:甲>乙 C、两溶液的质量:甲<乙 D、两溶液溶质的质量分数:甲>乙6.根据如图所示的溶解度曲线,下列叙述正确的是( )
 A、硝酸钾的溶解度比氯化钠大 B、tl℃时,氯化钠和硝酸钾的溶解度相等 C、t2℃时,80克硝酸钾溶于l00克水中得到的溶液为饱和溶液 D、t1℃硝酸钾的饱和溶液温度升高到t0℃,溶液质量分数增大7.
A、硝酸钾的溶解度比氯化钠大 B、tl℃时,氯化钠和硝酸钾的溶解度相等 C、t2℃时,80克硝酸钾溶于l00克水中得到的溶液为饱和溶液 D、t1℃硝酸钾的饱和溶液温度升高到t0℃,溶液质量分数增大7.如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )
 A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法8. 20℃时,将等质量的a、b两种不含结晶水的固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图甲;然后升温到50℃时,现象如图乙;a、b两种物质的溶解度曲线如图丙。由这一过程可知 ( )
A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法8. 20℃时,将等质量的a、b两种不含结晶水的固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图甲;然后升温到50℃时,现象如图乙;a、b两种物质的溶解度曲线如图丙。由这一过程可知 ( )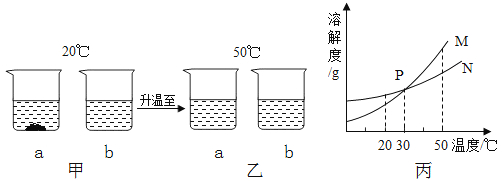 A、图甲中a溶液溶质质量分数比b溶液大 B、图乙中a、b溶液一定都是饱和溶液 C、图丙中表示a的溶解度曲线是M D、30℃时a、b溶液溶质质量分数不相等9. 今有60g溶质的质量分数为10%的NaNO3溶液,欲将其溶质的质量分数增大一倍,应采用的方法是( )A、把溶剂蒸发掉一半 B、加入6gNaNO3晶体 C、把溶剂蒸发掉30g D、加入20%的NaNO3溶液30g10. 如图,用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为 配制溶质的质量分数为 10%的氯化钠溶液。下列说法中,正确的是( )
A、图甲中a溶液溶质质量分数比b溶液大 B、图乙中a、b溶液一定都是饱和溶液 C、图丙中表示a的溶解度曲线是M D、30℃时a、b溶液溶质质量分数不相等9. 今有60g溶质的质量分数为10%的NaNO3溶液,欲将其溶质的质量分数增大一倍,应采用的方法是( )A、把溶剂蒸发掉一半 B、加入6gNaNO3晶体 C、把溶剂蒸发掉30g D、加入20%的NaNO3溶液30g10. 如图,用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为 配制溶质的质量分数为 10%的氯化钠溶液。下列说法中,正确的是( )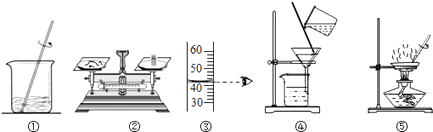 A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B、甲实验各步操作中,玻璃棒的作用都是相同的 C、乙实验若按照②③①的步骤进行操作,②中称取食盐为 5g,则配制的溶液浓度偏大 D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响11. 甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法 正确的是( )
A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B、甲实验各步操作中,玻璃棒的作用都是相同的 C、乙实验若按照②③①的步骤进行操作,②中称取食盐为 5g,则配制的溶液浓度偏大 D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响11. 甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法 正确的是( )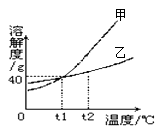 A、甲物质的溶解度大于乙物质的溶解度 B、t1℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g C、t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D、t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙12. M是硝酸钾或氯化铵其中的一种,硝酸钾和氯化铵在不同温度(t0<t1<t2)时的溶解度如下表所示:
A、甲物质的溶解度大于乙物质的溶解度 B、t1℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g C、t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D、t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙12. M是硝酸钾或氯化铵其中的一种,硝酸钾和氯化铵在不同温度(t0<t1<t2)时的溶解度如下表所示:温度(℃)
t0
t1
t2
硝酸钾溶解度/克
31.6
44
60
氯化铵溶解度/克
37.6
40
41
某科学兴趣小组用物质M进行了如图所示实验。下列说法不正确的是( )
 A、物质M是硝酸钾 B、溶液①为不饱和溶液,溶液②和③为饱和溶液 C、溶液②中溶质质量分数为37.5% D、溶液①②③中,溶质质量分数的关系是②>③>①13. 如图是 a、b、c 三种物质的溶解度曲线。由图示判断下列说法中不正确的是( )
A、物质M是硝酸钾 B、溶液①为不饱和溶液,溶液②和③为饱和溶液 C、溶液②中溶质质量分数为37.5% D、溶液①②③中,溶质质量分数的关系是②>③>①13. 如图是 a、b、c 三种物质的溶解度曲线。由图示判断下列说法中不正确的是( ) A、在 t1℃时,a 的溶解度等于 c 的溶解度 B、c 的溶解度随着温度升高而减少 C、a 的饱和溶液从 t2℃降温至 t1℃时变为不饱和溶液 D、当 a 中含有少量 b 时,可以用降温结晶的方法提纯 a14.
A、在 t1℃时,a 的溶解度等于 c 的溶解度 B、c 的溶解度随着温度升高而减少 C、a 的饱和溶液从 t2℃降温至 t1℃时变为不饱和溶液 D、当 a 中含有少量 b 时,可以用降温结晶的方法提纯 a14.如图是甲、乙两物质的溶解度曲线,下列说法错误的是 ( )
 A、t1℃时,甲、乙两物质的溶解度相等 B、将t1℃的甲、乙两物质的饱和溶液升温到t2℃时,两溶液仍然都是饱和溶液 C、当温度小于t1℃时,甲的溶解度小于乙的溶解度 D、将t2℃的甲、乙两物质的饱和溶液升温到t3℃时,两溶液的溶质质量分数都减小15. 一定温度下,向一定量的不饱和食盐水中加入食盐并充分搅拌,用纵坐标表示溶液中食盐的质量分数(a%),用横坐标表示实验进行的时间(t),其中正确的是( )
A、t1℃时,甲、乙两物质的溶解度相等 B、将t1℃的甲、乙两物质的饱和溶液升温到t2℃时,两溶液仍然都是饱和溶液 C、当温度小于t1℃时,甲的溶解度小于乙的溶解度 D、将t2℃的甲、乙两物质的饱和溶液升温到t3℃时,两溶液的溶质质量分数都减小15. 一定温度下,向一定量的不饱和食盐水中加入食盐并充分搅拌,用纵坐标表示溶液中食盐的质量分数(a%),用横坐标表示实验进行的时间(t),其中正确的是( )
A、 B、
B、 C、
C、 D、
D、 16. 甲、乙两种物质的溶解度曲线如图所示.下列说法中正确的是( )
16. 甲、乙两种物质的溶解度曲线如图所示.下列说法中正确的是( ) A、t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙17.
A、t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙17.甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )

A、t2℃时,向100g甲中加入100g水后形成溶液的质量为200g B、t1℃时,甲、乙两种物质的溶解度相等 C、甲的溶解度比乙大 D、将t2℃时甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等18.如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )
 A、50℃时,三种物质的溶解度由大到小的顺序是A>B>C B、50℃时,把50g A放入50g水中形成75g A的饱和溶液 C、20℃时,A和C两种物质的溶解度相等 D、分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是B>C=A19.
A、50℃时,三种物质的溶解度由大到小的顺序是A>B>C B、50℃时,把50g A放入50g水中形成75g A的饱和溶液 C、20℃时,A和C两种物质的溶解度相等 D、分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是B>C=A19.如图是甲、乙两种固体物质在水中的溶解度曲线,下列说法不正确的是( )

A、10℃时,甲、乙两种物质的饱和溶液浓度相同 B、保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液 C、30℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为80g D、10℃时,将两种饱和溶液升温至30℃,溶液中溶质的质量分数都增大20. 下列曲线能正确表达对应的反应或过程的是( )A、向一定量的水中加入生石灰 B、红磷在装有空气的密闭容器中燃烧
B、红磷在装有空气的密闭容器中燃烧 C、向一定质量的烧碱溶液中滴入盐酸
C、向一定质量的烧碱溶液中滴入盐酸 D、向饱和KNO3溶液中加入KMnO4固体
D、向饱和KNO3溶液中加入KMnO4固体
二、填空题
-
21. t℃时,两个装有100克水的烧杯中,分别加入不带结晶水的甲、乙物质各80克,充分搅拌。根据如图溶解度曲线判断,此时 溶液是饱和溶液,甲溶液的溶质质量分数是 。
 22.
22.概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。请回答:
 (1)、图中“?”是指;(2)、将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后完全溶解。你是如何确定食盐固体“完全溶解”的?。23. 20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示.
(1)、图中“?”是指;(2)、将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后完全溶解。你是如何确定食盐固体“完全溶解”的?。23. 20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示.
请回答下列问题:
(1)图1中一定是饱和溶液的是 溶液(填“甲”或“乙”);图2中乙溶液一定是溶液(填“饱和”或“不饱和”).
(2)图3中表示乙的溶解度曲线的是 (填“M”或“N”);图2中乙溶液降温至30℃ 析出晶体(填“会”或“不会”).
(3)50℃时甲的饱和溶液中溶质质量分数为 (计算结果精确到0.1%).
24.如图1是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 .
(2)t2℃时,将50g a物质放入50g水中充分溶解得到溶液的质量为 g.
(3)将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数由大到小的顺序是 .
(4)t1℃时,将盛有c的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,原因是 .
 25. 如图为甲、乙、丙三种物质的溶解度曲线.
25. 如图为甲、乙、丙三种物质的溶解度曲线.(1)图中A点表示的乙溶液为(填“饱和”或“不饱和”)溶液;
(2)t3℃时,将40g甲物质加入到50g水中,所得溶液溶质质量分数为 ;
(3)t3℃时,将等质量甲和丙的饱和溶液降温到t2℃,所得溶液质量大小关系为:甲丙(填“<”、“>”或“=”);
(4)将t1℃时丙的不饱和溶液变为饱和溶液可采取的方法为(填一种即可).
 26.
26.实验室要配制100g溶质质量分数为10%的氯化钠溶液.
①需氯化钠的质量为 .
②某同学按如图所示步骤依次操作:

其中操作错误的步骤是 (填字母序号).
③操作E中用玻璃棒搅拌,其目的是 .
三、实验探究题
-
27. 我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.(1)、
我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取实验的方法主要为“盐田法”,生产流程如下:

在蒸发池中促进水分蒸发,主要是利用了下列各项中的 .(填选项序号)
①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
(2)、金属镁广泛应用于生活、生产和国防工业,从卤水中提取镁的过程如图所示:

在上述转化过程中,①处发生的反应属于 反应.(填“中和”“复分解”“氧化”“化合”“分解”之一)
(3)、海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素.KCl和KNO3的溶解度曲线如图所示,试回答下列问题:

①t1℃时,KCl饱和溶液的溶质质量分数KNO3饱和溶液的溶质质量分数;(填“大于”“小于”“等于”之一)
②已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g,在20℃时,向盛有200g水的烧杯中加入80gKNO3 , 充分溶解,得到该温度时KNO3的(填“饱和”“不饱和”之一)溶液,若使烧杯内物质缓慢升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为 .(填最简整数比)
28. 放在普通环境里的鸡蛋容易变质。鲜鸡蛋密度约为1.08克/厘米3 , 变质蛋密度可降至1.03克/厘米3以下。生活中,我们可以把鸡蛋放入密度为1.03克/厘米3的盐水中来判断鸡蛋是否变质。(1)、如图甲、乙、丙三个鸡蛋静止在盐水中,其中最有可能已变质的是鸡蛋(选填“甲”、“乙”或“丙”);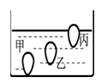 (2)、在配制一定质量分数的氯化钠溶液实验过程中要用到图2所示的仪器、细口瓶和一种玻璃仪器(填名称);
(2)、在配制一定质量分数的氯化钠溶液实验过程中要用到图2所示的仪器、细口瓶和一种玻璃仪器(填名称); (3)、在配制一定质量分数的氯化钠溶液实验中,用已调平的天平称取食盐固体时,发现指针偏右,接下来的操作是食盐(选填“增加”或“减少”);(4)、配制好溶液后,发现溶质质量分数偏小,其原因可能是(选填序号)。
(3)、在配制一定质量分数的氯化钠溶液实验中,用已调平的天平称取食盐固体时,发现指针偏右,接下来的操作是食盐(选填“增加”或“减少”);(4)、配制好溶液后,发现溶质质量分数偏小,其原因可能是(选填序号)。①食盐晶体不纯②配制溶液的烧杯用少量蒸馏水润洗③用量筒量取水时俯视读数④将配好的溶液转移到细口瓶时,有部分洒出
29. 某化学实验小组的同学要配制100g质量分数为18%的氯化钠溶液,下面是他们配制溶液的实验操作示意图,如图 (1)、该实验正确的操作顺序为。(填序号)(2)、在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是。同学们量取水最好选择合适的量筒,为精确量取还需另外仪器是。(3)、实验操作称量固体的质量及所量取的蒸馏水的体积如图所示,实际称取食盐质量为 , 实际配置的氯化钠溶液中溶质的质量分数为.
(1)、该实验正确的操作顺序为。(填序号)(2)、在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是。同学们量取水最好选择合适的量筒,为精确量取还需另外仪器是。(3)、实验操作称量固体的质量及所量取的蒸馏水的体积如图所示,实际称取食盐质量为 , 实际配置的氯化钠溶液中溶质的质量分数为. 30. 实验室需要配制15%的氯化钠溶液50g,实验操作如图所示:
30. 实验室需要配制15%的氯化钠溶液50g,实验操作如图所示: (1)、配制该溶液需要称取的氯化钠为g,选用的量筒规格为(填:20、50或100)mL。(2)、当用托盘天平称量所需的氯化钠时,发现天平的指针偏向左边,接下去的操作是。(3)、将A、B、C、D、E按正确操作顺序排列:。(4)、小娜同学所配制溶液的溶质质量分数偏小,原因可能是。(可多选)
(1)、配制该溶液需要称取的氯化钠为g,选用的量筒规格为(填:20、50或100)mL。(2)、当用托盘天平称量所需的氯化钠时,发现天平的指针偏向左边,接下去的操作是。(3)、将A、B、C、D、E按正确操作顺序排列:。(4)、小娜同学所配制溶液的溶质质量分数偏小,原因可能是。(可多选)①用生锈的砝码称量;②氯化钠与砝码的位置放反了;③氯化钠药品不纯;④用俯视法量取水;⑤装瓶时溶液飞溅出一部分;⑥纸上还有氯化钠颗粒剩余;
31. 如下图是配制50g质量分数为10%的氯化钠溶液的操作过程示意图。试回答: (1)、B操作中放好砝码和游码后,向托盘中加入氯化钠时,若指针偏向分度盘的左边,应进行的操作是。(2)、E操作的作用是。(3)、配制好的上述10%的氯化钠溶液50克,欲将其溶质质量分数增加到20%,可以采用的方法是 ( )
(1)、B操作中放好砝码和游码后,向托盘中加入氯化钠时,若指针偏向分度盘的左边,应进行的操作是。(2)、E操作的作用是。(3)、配制好的上述10%的氯化钠溶液50克,欲将其溶质质量分数增加到20%,可以采用的方法是 ( )①加入5克氯化钠固体 ②把水蒸 发掉25克 ③加入6.25克氯化钠固体 ④把溶液中的水蒸发掉一半
A、①② B、②③ C、③④ D、①④32. 小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液.考试时,小华进行了如图1所示的操作: (1)、称量时C出现了右盘低的现象,则接下来小华的操作是。(2)、以上实验的正确操作顺序为(用字母表示)。(3)、小华量取蒸馏水的体积如图2所示,则小华配制的碳酸钠溶液中溶质的质量分数为。(4)、下列原因能导致溶质质量分数偏低的是(填序号)。
(1)、称量时C出现了右盘低的现象,则接下来小华的操作是。(2)、以上实验的正确操作顺序为(用字母表示)。(3)、小华量取蒸馏水的体积如图2所示,则小华配制的碳酸钠溶液中溶质的质量分数为。(4)、下列原因能导致溶质质量分数偏低的是(填序号)。①碳酸钠不纯 ②称量时,砝码和药品放错
③向烧杯中倒水时,有水洒出 ④量取水仰视凹液面最低处读数
四、解答题
-
33. 一定温度下,将425 g含有A物质的溶液蒸发掉300 g水后,溶液恰好饱和;若另取85 g原溶液,加入25 g A物质和40 g水充分搅拌后,溶液也恰好饱和.求饱和溶液中溶质的质量分数是多少?34. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)
密度(g/mL)
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数(%)
1
10
20
30
40
50
60
70
80
90
98

有一物块A,其体积为250cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
(1)、求物块A静止时受到的浮力大小?(2)、求这种硫酸溶液的溶质质量分数是多少?(3)、要使物块A全部浸入溶液中,至少需要往容器中加水多少千克?(容器足够大,加水后溶液不溢出。)35. 下表为20℃盐酸的密度和盐酸中溶质质量分数对照表。20℃时,小明量取50毫升质量分数为36%的浓盐酸以配制稀盐酸。试回答:密度(克/厘米3)
1.025
1.05
1.075
1.1
1.125
1.15
1.18
溶质质量分数(%)
5
10
15
20
25
30
36
(1)、根据上表可得出的初步结论是:。(2)、50毫升溶质质量分数为36%的浓盐酸中含有溶质为克。(3)、小明用50毫升溶质质量分数为36%的浓盐酸可配制l0%的稀盐酸多少毫升?(写出计算过程,计算结果保留2位小数)36. 下表为硫酸的密度与硫酸溶液中溶质的质量分数对照表(20℃):密度(g/mL)
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数(%)
1
10
20
30
40
50
60
70
80
90
98
现有一物块A,其体积为500cm3 , 密度为1.30g/ cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出溶液面。
 (1)、求物块A静止时受到的浮力大小?(2)、求这种硫酸溶液的溶质质量分数是多少?(3)、要使物块A全部浸入溶液中,至少需要往容器中加水多少千克?(容器足够大,加水后溶液不溢出,g取10N/Kg)37. 如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。
(1)、求物块A静止时受到的浮力大小?(2)、求这种硫酸溶液的溶质质量分数是多少?(3)、要使物块A全部浸入溶液中,至少需要往容器中加水多少千克?(容器足够大,加水后溶液不溢出,g取10N/Kg)37. 如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。温度/℃
10
20
30
40
50
60
溶解度/g
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
20.9
31.6
45.8
63.9
85.5
110.0
(1)、两种物质中,溶解度受温度影响变化较大的是。(2)、60℃时,按图示操作:
A中溶液是(填“饱和”或“不饱和”)溶液,C中溶液的总质量是克。
(3)、50 ℃时,将两种物质的饱和溶液各100克,分别加热蒸发10克水后,再恢复到50 ℃,剩余溶液的质量:NaCl溶液(填“大于”“等于”或“小于”)KNO3溶液。(4)、10 ℃时,分别将两种物质各40克加入100克水后,求此时NaCl溶液的质量是多少?加热升高20℃后KNO3的溶液的质量溶质分数是多少?