辽宁省沈阳郊联体2021年高考化学5月模拟试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 化学与生产、生活、科技、环境等密切相关。下列说法错误的是( )A、生产医用口罩所用的原料丙烯,可以通过石油的裂化和裂解得到 B、竹筒酒产自低海拔山区,是由竹筒装着高粱浆酿造而成的,高粱酿酒发生了化学变化 C、用于盛装新冠疫苗的中硼硅玻璃管属于硅酸盐材质,既能耐低温,又能耐强酸 D、新疆长绒棉因纤维较长而得名,棉花的主要成分是纤维素,纤维素与淀粉互为同分异构体2. 化学用语是化学重要的组成部分,下列关于化学用语的说法正确的是( )A、异戊烷又称2-甲基戊烷,其键线式:
 B、羟基的电子式:
B、羟基的电子式: 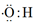 C、乙炔的比例模型:
C、乙炔的比例模型:  D、1-丙醇的结构简式:
3. 物质的性质决定其用途。下列物质的性质与用途对应正确的是( )
D、1-丙醇的结构简式:
3. 物质的性质决定其用途。下列物质的性质与用途对应正确的是( )性质
用途
A
氨气易溶于水
可用作制冷剂
B
铜的金属活动性比铝的弱
铜罐代替铝罐贮运浓硝酸
C
石英坩埚耐高温
用来加热熔化烧碱、纯碱等固体
D
碳酸氢钠溶液和硫酸铝溶液混合,产生大量气泡
用作泡沫灭火器的原料
A、A B、B C、C D、D4. 下列分子的 模型不是四面体形的是( )A、 B、 C、 D、5. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、在高温、高压和催化剂的条件下, 与足量 反应,转移的电子数为 B、 溶液中 的浓度为 ,则 该溶液中含有的 的数目大于 C、常温下, 的 溶液中,由水电离出的 的数目为 D、标准状况下, 与 恰好完全反应,生成物中气体分子的数目为6. 叔丁基溴在稀的碱性水溶液中水解生成叔丁醇的反应分三步进行,反应中每一步的能量变化曲线如图所示,下列有关说法错误的是( ) A、叔丁基溴在稀的碱性水溶液中生成叔丁醇的反应是放热反应 B、 和 为反应活性中间体 C、决定叔丁基溴水解生成叔丁醇反应的速率的是第二步反应 D、第三步反应为7. 科学家在对原子结构进行分析研究时,用中子( )轰击金属原子 ,得到核素 和 H: 。元素Y的原子半径在短周期元素中最大。下列叙述错误的是( )A、 的质量数为23 B、Y的常见氧化物有Y2O、Y2O2 C、X的最高价氧化物对应水化物的碱性比Y的强 D、工业上通过电解熔融X或Y的氯化物来制取单质X或Y8. 根据溶液中发生的两个反应:① ;② 。下列说法错误的是( )A、反应①中氧化剂和还原剂的物质的量之比为 B、酸性条件下,氧化性: C、实验室将高锰酸钾酸化时,常用硫酸酸化而不用盐酸酸化 D、反应②中每生成 的气体,则反应中转移的电子的物质的量为9. 布洛芬具有降温和抑制肺部炎症的双重作用。一种由M制备布洛芬的反应如图,下列有关说法正确的是( )
A、叔丁基溴在稀的碱性水溶液中生成叔丁醇的反应是放热反应 B、 和 为反应活性中间体 C、决定叔丁基溴水解生成叔丁醇反应的速率的是第二步反应 D、第三步反应为7. 科学家在对原子结构进行分析研究时,用中子( )轰击金属原子 ,得到核素 和 H: 。元素Y的原子半径在短周期元素中最大。下列叙述错误的是( )A、 的质量数为23 B、Y的常见氧化物有Y2O、Y2O2 C、X的最高价氧化物对应水化物的碱性比Y的强 D、工业上通过电解熔融X或Y的氯化物来制取单质X或Y8. 根据溶液中发生的两个反应:① ;② 。下列说法错误的是( )A、反应①中氧化剂和还原剂的物质的量之比为 B、酸性条件下,氧化性: C、实验室将高锰酸钾酸化时,常用硫酸酸化而不用盐酸酸化 D、反应②中每生成 的气体,则反应中转移的电子的物质的量为9. 布洛芬具有降温和抑制肺部炎症的双重作用。一种由M制备布洛芬的反应如图,下列有关说法正确的是( ) A、布洛芬中所有碳原子一定处于同一平面 B、有机物M和布洛芬均能发生水解、取代、消去和加成反应 C、有机物M和布洛芬都能与金属钠反应产生 D、有机物M和布洛芬均可与碳酸钠溶液反应产生二氧化碳10. 利用下列装置进行实验,不能达到实验目的的是( )
A、布洛芬中所有碳原子一定处于同一平面 B、有机物M和布洛芬均能发生水解、取代、消去和加成反应 C、有机物M和布洛芬都能与金属钠反应产生 D、有机物M和布洛芬均可与碳酸钠溶液反应产生二氧化碳10. 利用下列装置进行实验,不能达到实验目的的是( )A
B
C
D
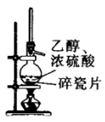

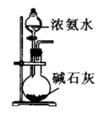

制取
验证 具有漂白性
制取少量
检验该条件下铁发生了吸氧腐蚀
A、A B、B C、C D、D11. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如下实验:
下列说法正确的是( )
A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 和 D、滤液X中大量存在的阳离子有 和12. 一种以锌一石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有 ,可表示为 )为正极、盐一水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法错误的( )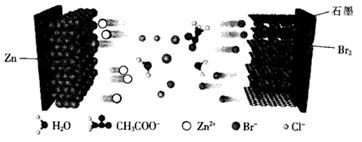 A、放电时,石墨烯气凝胶电极上的电极反应式为 B、多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面 C、电池总反应为 D、充电时, 被还原, 在石墨烯纤维无纺布电极侧沉积, 被氧化后在阴极嵌入13. X、Y、Z、W是四种短周期主族元素,其在元素周期表中的相对位置如图所示。Z的最高正价与最低负价的代数和为4。下列说法正确的是( )
A、放电时,石墨烯气凝胶电极上的电极反应式为 B、多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面 C、电池总反应为 D、充电时, 被还原, 在石墨烯纤维无纺布电极侧沉积, 被氧化后在阴极嵌入13. X、Y、Z、W是四种短周期主族元素,其在元素周期表中的相对位置如图所示。Z的最高正价与最低负价的代数和为4。下列说法正确的是( )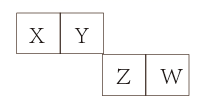 A、电负性: B、元素Y的最简单氢化物的中心原子Y采用 杂化 C、元素X和Z形成的化合物中可能所有原子都达到了8电子稳定结构 D、元素Z的氧化物对应水化物的酸性比Y的强14. 下列物质(括号内为杂质)的除杂试剂和除杂方法均正确的是( )
A、电负性: B、元素Y的最简单氢化物的中心原子Y采用 杂化 C、元素X和Z形成的化合物中可能所有原子都达到了8电子稳定结构 D、元素Z的氧化物对应水化物的酸性比Y的强14. 下列物质(括号内为杂质)的除杂试剂和除杂方法均正确的是( )选项
物质
除杂试剂
除杂方法
A
(HCl)
饱和 溶液
洗气
B
乙酸乙酯(乙酸)
乙醇、浓硫酸
分液
C
(CO)
通过灼热的C
洗气
D
溶液( )
过量的
过滤
A、A B、B C、C D、D15. 常温下,向 溶液中滴加 的 溶液时, ( 、 或 )随V( 溶液)变化的曲线如图。下列叙述错误的是( )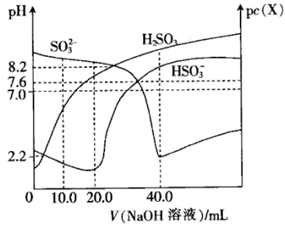 A、常温下, 的第一步电离平衡常数 B、当V( 溶液) 时, C、V( 溶液) 时,水的电离程度最大 D、常温下,当 时,有
A、常温下, 的第一步电离平衡常数 B、当V( 溶液) 时, C、V( 溶液) 时,水的电离程度最大 D、常温下,当 时,有二、非选择题
-
16. 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
 (1)、加碱浸取时,为提高钌的浸出率可采取的措施有(任写两点)。(2)、操作X的名称为。(3)、“研磨预处理”是将研磨后的含钌废料在氢气还原炉中还原为单质钌,再进行“碱浸”获得 ,写出“碱浸”时生成 的离子方程式:。(4)、“滤渣”的主要成分为 ,加入草酸的作用是 , 金属钌与草酸的质量比x和反应温度T对钌的回收率的影响如图所示,则回收钌较为适宜的条件是。
(1)、加碱浸取时,为提高钌的浸出率可采取的措施有(任写两点)。(2)、操作X的名称为。(3)、“研磨预处理”是将研磨后的含钌废料在氢气还原炉中还原为单质钌,再进行“碱浸”获得 ,写出“碱浸”时生成 的离子方程式:。(4)、“滤渣”的主要成分为 ,加入草酸的作用是 , 金属钌与草酸的质量比x和反应温度T对钌的回收率的影响如图所示,则回收钌较为适宜的条件是。
在酸性介质中,若使用 溶液代替草酸,可获得 ,则反应中氧化剂和还原剂的物质的量之比为。
(5)、“一系列操作”为 , 写出在“还原炉”中还原制得钌的化学方程式:。17. 某实验小组以回收站回收的废铁制品(主要成分为Fe,还含有少量的 和 )为原料制备 晶体。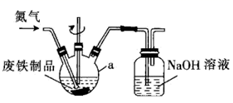 (1)、取10g废铁制品,用质量分数为10%的碳酸钠溶液浸泡一段时间,然后用倾析法倒去碳酸钠溶液,用蒸馏水洗涤2~3次,将洗涤好的废铁制品加入如图所示装置中,再加入 硫酸。控制温度在 之间,加热 ,将所得溶液趁热过滤冷却结晶、过滤洗涤,得到 晶体。
(1)、取10g废铁制品,用质量分数为10%的碳酸钠溶液浸泡一段时间,然后用倾析法倒去碳酸钠溶液,用蒸馏水洗涤2~3次,将洗涤好的废铁制品加入如图所示装置中,再加入 硫酸。控制温度在 之间,加热 ,将所得溶液趁热过滤冷却结晶、过滤洗涤,得到 晶体。①仪器a的名称为。
②基态Fe原子的价电子排布式为 , 有个未成对电子。
③反应中需要控制温度在 之间,宜采用的方法是。
④用冰水洗涤 晶体的操作是 , 若将 晶体在隔绝空气条件下加热到800℃,会生成红棕色固体,写出反应的化学方程式:。
(2)、若以赤铁矿渣(含有 和 杂质)为原料制备 晶体,请补充完整相应的实验方案:①取一定量的赤铁矿渣,分次加入足量的稀硫酸,充分反应后过滤。
②取滤液,。
③过滤、洗涤,将沉淀溶入 的硫酸中,同时加入过量铁粉,充分反应后,过滤,向滤液中加乙醇,在恒温水浴槽中冷却结晶、过滤,用丙酮洗涤、干燥。
已知:该实验中 时, 沉淀完全; 时, 开始沉淀。实验室现有试剂: 的 溶液、 的 溶液、铁粉。
(3)、通过下列方法测定产品纯度:准确称取 样品,加适量水溶解,配成 溶液,取 溶液置于锥形瓶中,用 的酸性 标准溶液滴定(杂质不与酸性 标准溶液反应),经3次测定,每次消耗 溶液的体积如下表所示:实验序号
1
2
3
消耗 溶液的体积
19.98
20.58
20.02
通过计算确定产品中 的质量分数约为(保留三位有效数字)。
18. “加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题。工业生产产生的含 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。(1)、在一定条件下,肼( )与 反应能生成 和 。已知:① ;
② ;
③ ;
则反应 的 。
(2)、在一恒容密闭容器中发生反应: 。当温度高于250℃时,正、逆反应速率分别为 分别为正、逆反应速率常数, 、 与该反应的平衡常数 之间的关系为。速率常数 随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数(填“>”、“<”或“=”) 增大的倍数。(3)、在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为 。向两个容积均为2L的恒容密闭容器中均分别充入 和 ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为 ,曲线II代表的体系平衡后气体的总压强为 。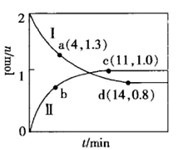
①代表220℃条件下的变化曲线为(填“I”或“II”);ad段 的平均反应速率为 。
②下列有关曲线II条件下的反应的说法正确的是(填标号)。
A.当体系中 与 的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
③图中a、c、d三点对应的逆反应速率由大到小的顺序为(用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp= (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
19. 有机物F(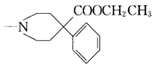 )是一种镇痛药,它的一种合成路线如下:
)是一种镇痛药,它的一种合成路线如下: 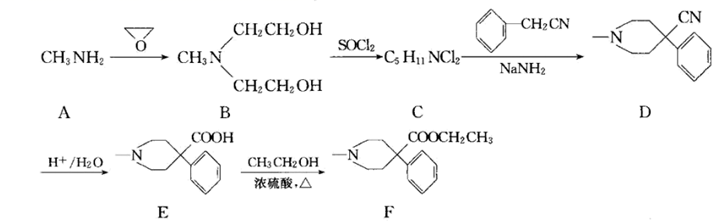 (1)、
(1)、 的名称为。 (2)、B→C的反应类型是反应。(3)、F中的含氧官能团的名称为。(4)、A分子所含σ键的数目为。(5)、写出反应E→F的化学方程式:。(6)、H为E的同分异构体且H分子中含有
的名称为。 (2)、B→C的反应类型是反应。(3)、F中的含氧官能团的名称为。(4)、A分子所含σ键的数目为。(5)、写出反应E→F的化学方程式:。(6)、H为E的同分异构体且H分子中含有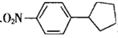 结构,写出其中核磁共振氢谱显示有5组峰且峰面积之比为 的H的结构简式:(任写一种)。 (7)、已知: 。写出以 、 为原料制取
结构,写出其中核磁共振氢谱显示有5组峰且峰面积之比为 的H的结构简式:(任写一种)。 (7)、已知: 。写出以 、 为原料制取 的合成路线流程图(无机试剂和有机溶剂可任选,合成示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂可任选,合成示例见本题题干)。