辽宁省葫芦岛市2021年高考化学二模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 2021年我国取得让世界瞩目的科技成果,化学功不可没。下列说法错误的是( )A、“嫦娥五号”运载火箭用液氧液氢推进剂,产物对环境无污染 B、“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅 C、“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷属于新型无机非金属材料 D、“奋斗者”号潜水器外壳材料为钛合金,钛合金耐高压、耐腐蚀2. 利用反应5NaCl+2CO2+2H2O 5NaClO+C2H4O(环氧乙烷)可实现低压高效电催化还原CO2。下列化学用语错误的是( )A、Cl原子的原子结构示意图
 B、NaClO的电子式:
B、NaClO的电子式: 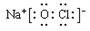 C、CO2的球棍模型:
C、CO2的球棍模型:  D、环氧乙烷的结构简式:
D、环氧乙烷的结构简式: 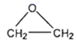 3. 化合物
3. 化合物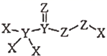 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( ) A、原子半径:Z>Y>X B、Z的第一电离能比同周期相邻元素都大 C、1mol该化合物分子中含有的非极性键数目为2NA D、该化合物中X、Y、Z都满足8电子稳定结构4. 下列装置所示的实验中,能达到实验目的的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( ) A、原子半径:Z>Y>X B、Z的第一电离能比同周期相邻元素都大 C、1mol该化合物分子中含有的非极性键数目为2NA D、该化合物中X、Y、Z都满足8电子稳定结构4. 下列装置所示的实验中,能达到实验目的的是( )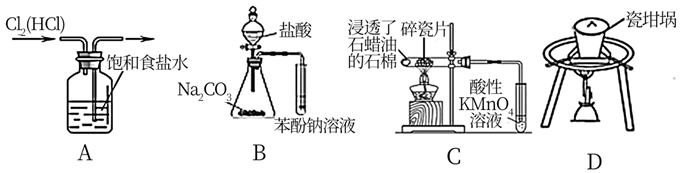 A、除去Cl2中混有的HCl杂质 B、比较碳酸与苯酚酸性强弱 C、验证石蜡油分解的产物含有不饱和烃 D、熔化Na2CO3固体5. 检验Ni2+反应的一种生成物为丁二酮肟镍,是一种鲜红色沉淀,其分子结构如图所示。下列说法正确的是( )
A、除去Cl2中混有的HCl杂质 B、比较碳酸与苯酚酸性强弱 C、验证石蜡油分解的产物含有不饱和烃 D、熔化Na2CO3固体5. 检验Ni2+反应的一种生成物为丁二酮肟镍,是一种鲜红色沉淀,其分子结构如图所示。下列说法正确的是( )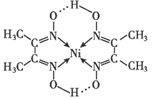 A、Ni2+核外有14种运动状态不同的电子 B、该分子内微粒之间存在的作用力有共价键、配位键、离子键、氢键 C、基态N原子的价电子排布图
A、Ni2+核外有14种运动状态不同的电子 B、该分子内微粒之间存在的作用力有共价键、配位键、离子键、氢键 C、基态N原子的价电子排布图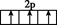 D、H2O中有2个由s轨道与sp3杂化轨道形成的σ键
6. FeO晶胞结构如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数为NA , 晶体的密度为dg/cm3 , 下列说法错误的是( )
D、H2O中有2个由s轨道与sp3杂化轨道形成的σ键
6. FeO晶胞结构如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数为NA , 晶体的密度为dg/cm3 , 下列说法错误的是( )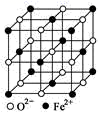 A、Fe位于第四周期第ⅧB族,属于d区 B、Fe2+的电子排布简式为[Ar]3d6 C、该晶体中,距Fe2+最近的O2-形成正八面体 D、该晶体中两个距离最近的同种离子的核间距为 cm7. 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始 =Z,在恒压下,平衡时
A、Fe位于第四周期第ⅧB族,属于d区 B、Fe2+的电子排布简式为[Ar]3d6 C、该晶体中,距Fe2+最近的O2-形成正八面体 D、该晶体中两个距离最近的同种离子的核间距为 cm7. 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始 =Z,在恒压下,平衡时 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )  A、该反应的焓变△H<0 B、图中Z的大小为a>3>b C、图中X点对应的平衡混合物中 >3 D、温度不变时,图中X点对应的平衡在加压后
A、该反应的焓变△H<0 B、图中Z的大小为a>3>b C、图中X点对应的平衡混合物中 >3 D、温度不变时,图中X点对应的平衡在加压后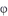 (CH4)减小
8. 最新研究中发现“阿比朵尔”是抗击新型冠状病毒的潜在用药。
(CH4)减小
8. 最新研究中发现“阿比朵尔”是抗击新型冠状病毒的潜在用药。 是合成“阿比朵尔”的一种中间体,下列有关该中间体的说法正确的是( ) A、该物质分子中含有3种官能团 B、1mol该物质最多能与3molH2发生完全加成反应 C、1mol该物质只能与1molNaOH完全反应 D、该物质分子中共面的碳原子最多有7个9. 《JournalofEnergyChemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是( )
是合成“阿比朵尔”的一种中间体,下列有关该中间体的说法正确的是( ) A、该物质分子中含有3种官能团 B、1mol该物质最多能与3molH2发生完全加成反应 C、1mol该物质只能与1molNaOH完全反应 D、该物质分子中共面的碳原子最多有7个9. 《JournalofEnergyChemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是( )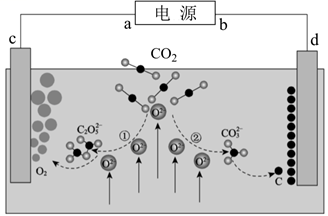 A、由图可知捕获CO2过程的初期发生了氧化还原反应 B、熔盐可用CCl4代替 C、d极电极反应式为 -4e-=C+3O2- D、转移1mol电子该装置最终可捕获CO25.6L(标况下)10. 下列实验操作、现象及结论都正确的是( )
A、由图可知捕获CO2过程的初期发生了氧化还原反应 B、熔盐可用CCl4代替 C、d极电极反应式为 -4e-=C+3O2- D、转移1mol电子该装置最终可捕获CO25.6L(标况下)10. 下列实验操作、现象及结论都正确的是( )选项
实验操作
现象
结论
A
将Fe(NO3)2样品溶于足量的H2SO4溶液中,再滴加少量的KSCN溶液
溶液不变红
溶液中一定没有Fe3+
B
向滴加酚酞的氨水中加蒸馏水稀释
溶液红色变浅
溶液中所有离子浓度均减小
C
向Na2CO3稀溶液中逐滴滴入同浓度、同体积的水杨酸(
 )溶液,边滴加边振荡
)溶液,边滴加边振荡无气体产生
电离常数:K1(碳酸)>K2(水杨酸)
D
取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液
无淡黄色沉淀
CH3CH2Br没有水解
A、A B、B C、C D、D11. 工业上为了除去锅炉中的水垢,要向锅炉里注入Na2CO3溶液浸泡一段时间,下列叙述正确的是( )A、若c(Na2CO3)=c[(NH4)2CO3],则两溶液中c(CO )也相等 B、锅炉中加入Na2CO3溶液发生反应的离子方程式为CO (aq)+CaSO4(s) CaCO3(s)+SO (aq) C、盐酸溶液中,Ksp(CaCO3)增大,Ksp(CaSO4)减小 D、向Na2CO3溶液中通入适量的CO2使溶液呈中性时,c(Na+)=c(CO )+c(HCO )12. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以废催化剂为原料,进行回收利用。设计实验流程如图: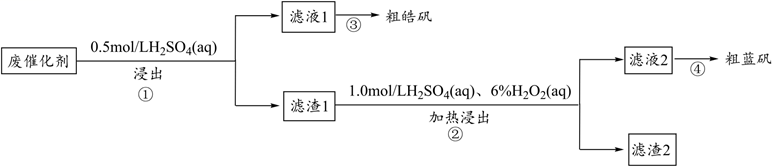 已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )A、步骤①操作中,生成的气体可用碱液吸收 B、滤液1中是否含有Fe2+ , 可以选用KSCN和新制的氯水检验 C、滤渣1成分是SiO2和CuS,滤渣2成分一定是SiO2 D、步骤④要滴加稀硫酸防止CuSO4水解13. 如图为拟通过甲装置除去污水中的乙酸钠和对氯苯酚,同时利用此装置产生的电能进行粗铜的精炼。下列说法错误的是( )
已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )A、步骤①操作中,生成的气体可用碱液吸收 B、滤液1中是否含有Fe2+ , 可以选用KSCN和新制的氯水检验 C、滤渣1成分是SiO2和CuS,滤渣2成分一定是SiO2 D、步骤④要滴加稀硫酸防止CuSO4水解13. 如图为拟通过甲装置除去污水中的乙酸钠和对氯苯酚,同时利用此装置产生的电能进行粗铜的精炼。下列说法错误的是( ) A、X极为阴极,发生还原反应 B、当电路中有0.2mol电子通过时,Y极质量可能减少3.2g C、A极的电极反应式:
A、X极为阴极,发生还原反应 B、当电路中有0.2mol电子通过时,Y极质量可能减少3.2g C、A极的电极反应式: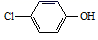 +e-=
+e-= 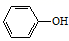 +Cl-
D、工作时,B极附近液体pH值减小
14. 通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:
+Cl-
D、工作时,B极附近液体pH值减小
14. 通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12。
下列说法正确的是( )
A、滴定选用的指示剂为甲基橙 B、本次实验测得Cl元素的质量分数为 % C、硝基苯的作用为防止沉淀被氧化 D、若取消步骤Ⅲ,测定结果偏大15. 常温下,用NaOH溶液滴定H2A溶液,混合溶液的pH与离子浓度的负对数pX的关系如图所示。pX代表-lg 或-lg ,下列说法正确的是( )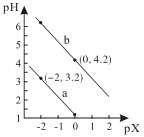 A、曲线a表示pH与-lg 的变化关系 B、当H2A被完全中和时,c(OH-)=c(HA-)+c(H2A)+c(H+) C、当NaOH与H2A等量反应后,溶液可能呈碱性 D、H2A的第一步电离常数为10-1.2
A、曲线a表示pH与-lg 的变化关系 B、当H2A被完全中和时,c(OH-)=c(HA-)+c(H2A)+c(H+) C、当NaOH与H2A等量反应后,溶液可能呈碱性 D、H2A的第一步电离常数为10-1.2二、非选择题
-
16. NiSO4·6H2O是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池、医药工业、催化行业以及印染工业等行业中。由一种废料(主要成分是铁镍合金,还含有铜、镁、硅的氧化物)为原料制取NiSO4·6H2O步骤如图:

已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价;
②常温下Ksp(MgF2)=6.4×10-9 , Ka(HF)=6.3×10-4;
(1)、NiSO4中阴离子的空间构型为。(2)、“溶解”时加入H2O2溶液的目的是。(3)、“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出其离子方程式。(4)、向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液的pH偏低,将会导致MgF2沉淀不完全,其原因是。(5)、“沉镍”后所得滤液中,可循环使用的主要溶质为(填化学式)。(6)、NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的化学方程式为。(7)、在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是。17. 汽车尾气中的NO和CO会对环境造成很大影响,我国科学家在以H2为还原剂清除NO、CO的研究方面取得了显著成果。回答下列问题:(1)、以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水可以制H2。已知:2H2O(l)=2H2(g)+O2(g) △H1=+571.0kJ•mol-1
2Fe3O4(s)=6FeO(s)+O2(g) △H2=+313.2kJ•mol-1
则3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H3=kJ•mol-1
(2)、H2还原NO的化学方程式为2NO(g)+2H2(g) N2(g)+2H2O(g) △H<0。①研究表明上述反应历程分两步:
Ⅰ.2NO(g)+H2(g) N2(g)+H2O2(1)(慢反应)
Ⅱ.H2O2(1)+H2(g) 2H2O(g)(快反应)
该总反应的速率由反应(填“Ⅰ”或“Ⅱ”)决定,反应Ⅰ的活化能比反应Ⅱ的活化能(填“高”或“低”)。
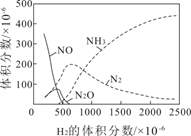
②该反应常伴有副产物N2O和NH3。以Pt作催化剂,用H2还原某废气中的NO(其他气体不反应),270℃时H2的体积分数对H2—NO反应的影响如图所示。随着H2体积分数的增大,N2的体积分数呈下降趋势,原因是。
 (3)、一定温度下,在容积恒为1L的容器中通入一定量N2O4 , 发生反应N2O4 2NO2△H<0,体系中各组分浓度随(t)的变化如表。
(3)、一定温度下,在容积恒为1L的容器中通入一定量N2O4 , 发生反应N2O4 2NO2△H<0,体系中各组分浓度随(t)的变化如表。t/s
0
20
40
60
80
c(N2O4)/(mol/L)
0.100
0.062
0.048
0.040
0.040
c(NO2)/(mol/L)
0
0.076
0.104
0.120
0.120
①0~40s,N2O4的平均反应速率为。
②反应达到平衡后再充入N2O4mol,才能使再次达到平衡时,NO2的浓度为0.24mol/L。
(4)、H2还原CO的化学方程式为CO(g)+2H2(g) CH3OH(g)△H<0,在密闭容器中,以浓度之比1:2通入CO和H2 , 反应经历相同时间,测得不同温度下CO的转化率如图所示,则160℃时,v正v逆(填“>”或“<”)。若起始时c(CO)=amol•L-1 , 则380℃时该反应的化学平衡常数K=(用含有a的式子表示)。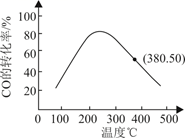 18. 硫氰酸钾(KSCN),是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
18. 硫氰酸钾(KSCN),是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。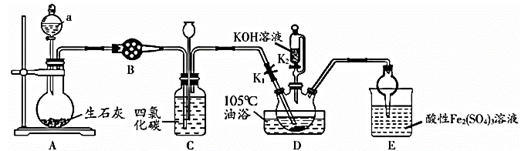
已知:① 不溶于 和 不溶于水且密度比水大;
②D中三颈烧瓶内盛放 、水和催化剂,发生反应 ,该反应比较缓慢且 在高于170℃时易分解, 在高于25℃时即分解。
回答下列问题:
(1)、试剂a是 , 装置D中盛装KOH溶液的仪器名称是。(2)、制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。①反应一段时间后,关闭K1 , 此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是。
②打开K2 , 缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)、装置E中发生氧化还原反应的离子方程式是。(4)、制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经(填操作名称)、减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。(5)、取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验: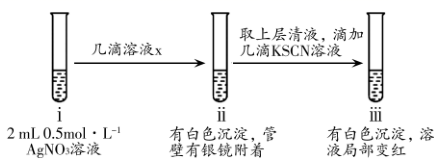
①设计实验探究ⅱ中银镜产生的原因。
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:。
19. 西药盐酸沙格雷酯片为抗血小板药。用于改善慢性动脉闭塞症所引起的溃疡、疼痛以及冷感等缺血性诸症状。化合物G是合成药物盐酸沙格雷酯的重要中间体,其合成路线如图: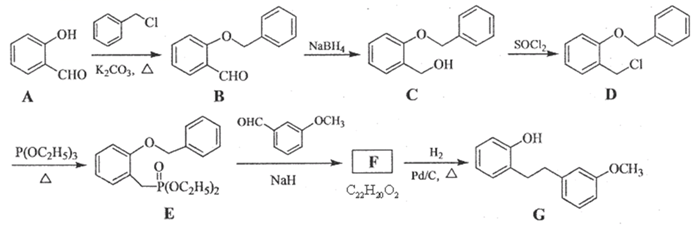 (1)、G中官能团的名称是。(2)、A与对羟基苯甲醛互为同分异构体。A的熔点比对羟基苯甲醛的低,其原因是。(3)、B→C的反应类型为。(4)、写出D到E的化学方程式。(5)、上述合成路线中,F到G反应含有加成反应且还有另一种芳香化合物生成,F的结构简式为。(6)、
(1)、G中官能团的名称是。(2)、A与对羟基苯甲醛互为同分异构体。A的熔点比对羟基苯甲醛的低,其原因是。(3)、B→C的反应类型为。(4)、写出D到E的化学方程式。(5)、上述合成路线中,F到G反应含有加成反应且还有另一种芳香化合物生成,F的结构简式为。(6)、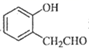 是A的同系物,其同分异构体有多种:
是A的同系物,其同分异构体有多种: ⅰ.属于芳香化合物 ⅱ.能发生水解反应 ⅲ.能发生银镜反应
符合上述条件的同分异构体有种,其中核磁共振氢谱峰面积之比为3:2:2:1的结构简式为。