江西省鹰潭市2021年高考化学一模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 化学与生产、生活和社会发展密切相关,下列叙述正确的是( )A、碳纳米管属于胶体,具有较高强度 B、淀粉、纤维素、脂肪、蛋白质都是天然高分子化合物 C、除去锅炉中的水垢时,可先用碳酸钠溶液处理,使水垢蓬松,再加入酸去除 D、碳酸钡可用于肠胃X射线造影检查2. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
 下列说法错误的是( )A、使用催化剂不能降低水煤气变换反应的 B、过程Ⅰ、过程Ⅱ均为吸热过程 C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个 在反应过程中并未都参与了反应3. 短周期主族元素L、X、Y、Z、W的原子序数依次递增,其中只有一种金属元素,L和Y、X和Z分别位于同一主族,由X、Y、Z三种元素形成的化合物M结构如图所示,在工业上可用作漂白剂,下列叙述正确的是( )
下列说法错误的是( )A、使用催化剂不能降低水煤气变换反应的 B、过程Ⅰ、过程Ⅱ均为吸热过程 C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个 在反应过程中并未都参与了反应3. 短周期主族元素L、X、Y、Z、W的原子序数依次递增,其中只有一种金属元素,L和Y、X和Z分别位于同一主族,由X、Y、Z三种元素形成的化合物M结构如图所示,在工业上可用作漂白剂,下列叙述正确的是( ) A、简单离子半径: B、 溶液与Z的最高价氧化物对应的水化物的稀溶液反应有黄色浑浊和无色气体产生 C、Z、W的氧化物对应的水化物均为强酸 D、X、Z、W分别与L形成的最简单化合物中W的沸点最高4. 碱性硼化钒(VB2)一空气电池工作时反应为 。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过 电子时,B装置内共收集到 气体(标准状况下),则下列说法错误的是( )
A、简单离子半径: B、 溶液与Z的最高价氧化物对应的水化物的稀溶液反应有黄色浑浊和无色气体产生 C、Z、W的氧化物对应的水化物均为强酸 D、X、Z、W分别与L形成的最简单化合物中W的沸点最高4. 碱性硼化钒(VB2)一空气电池工作时反应为 。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过 电子时,B装置内共收集到 气体(标准状况下),则下列说法错误的是( ) A、VB2电极发生的电极反应为 B、外电路中电流由c电极流向VB2电极 C、电解过程中,b电极表面有气泡产生 D、若B装置内的液体体积为 ,则 溶液的物质的量浓度为5. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
A、VB2电极发生的电极反应为 B、外电路中电流由c电极流向VB2电极 C、电解过程中,b电极表面有气泡产生 D、若B装置内的液体体积为 ,则 溶液的物质的量浓度为5. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项
实验
现象
结论
A
相同温度下,用 试纸测 溶液和 溶液的
测 溶液试纸显蓝色;测 溶液的试纸显深蓝色
相同温度下
B
取 和 完全反应后固体,溶于足量稀硫酸,滴加 溶液
溶液不变红
反应后固体中可能含有
C
将湿润的淀粉- 试纸放入含有红棕色气体的集气瓶中
试纸变蓝
该气体为 ,具有氧化性
D
将少量 加水溶解后,滴加稀硫酸酸化,再滴加 溶液
溶液呈血红色
已变质
A、A B、B C、C D、D6. 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有高度特异性,其分子结构如图所示。下列说法错误的是( ) A、该物质的分子式为: B、1个该分子含有5个手性碳原子(手性碳原子是一个碳原子连有四个不同的原子或原子团) C、在一定条件下,该物质可以发生消去、加成、取代反应 D、该物质能使酸性高锰酸钾溶液褪色7. 常温下将 溶液滴加到 溶液中,混合溶液的 与离子浓度变化的关系如图所示(纵坐标为 或 。下列叙述错误的是( )
A、该物质的分子式为: B、1个该分子含有5个手性碳原子(手性碳原子是一个碳原子连有四个不同的原子或原子团) C、在一定条件下,该物质可以发生消去、加成、取代反应 D、该物质能使酸性高锰酸钾溶液褪色7. 常温下将 溶液滴加到 溶液中,混合溶液的 与离子浓度变化的关系如图所示(纵坐标为 或 。下列叙述错误的是( ) A、曲线M表示 与 B、图中a点对应溶液中: C、 与 之比为 D、 溶液中:
A、曲线M表示 与 B、图中a点对应溶液中: C、 与 之比为 D、 溶液中:二、非选择题
-
8. 硼、镁及其化合物在工农业生产中应用广泛。已知硼镁矿的主要成分为 ,硼砂的化学式为 。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图1所示。
 (1)、硼砂中B的化合价为。(2)、在实验室 可以用 与水反应得到,且反应前后B的化合价不变,该反应的化学方程式为。X为氧化物,是 晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为。(3)、短周期元素M与B同一主族,其单质在 时可与 反应制备MN,在这种单质中添加少量 固体并充分混合,有利于 的制备,其主要原因是。(4)、制得的粗硼在一定条件下反应生成 , 在一定条件下受热分解可以得到纯净的单质硼。0.2000g粗硼制成的 完全分解,将生成的I2配制成 碘水,量取 碘水于锥形瓶中,向其中滴加几滴淀粉溶液,用 溶液滴定至终点,消耗 溶液 。(提示: )滴定终点的现象为 , 该粗硼样品的纯度为%。(5)、 [也可写成 ]可以通过电解 溶液的方法制备。工作原理如图2所示。
(1)、硼砂中B的化合价为。(2)、在实验室 可以用 与水反应得到,且反应前后B的化合价不变,该反应的化学方程式为。X为氧化物,是 晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为。(3)、短周期元素M与B同一主族,其单质在 时可与 反应制备MN,在这种单质中添加少量 固体并充分混合,有利于 的制备,其主要原因是。(4)、制得的粗硼在一定条件下反应生成 , 在一定条件下受热分解可以得到纯净的单质硼。0.2000g粗硼制成的 完全分解,将生成的I2配制成 碘水,量取 碘水于锥形瓶中,向其中滴加几滴淀粉溶液,用 溶液滴定至终点,消耗 溶液 。(提示: )滴定终点的现象为 , 该粗硼样品的纯度为%。(5)、 [也可写成 ]可以通过电解 溶液的方法制备。工作原理如图2所示。
理论上每生成 , 室可生成L(标准状况)气体。c膜为(填“阴离子”或“阳离子”)交换膜,N室中,进口和出口的溶液浓度大小关系为b mol∙L−1a mol∙L−1 (填“>”、“=”或“<”)。
9. 亚硝酸钠(NaNO2)易溶于水,微溶于乙醇,可作为肉类食品的护色剂,并可以防止肉毒杆菌在肉类食品中生长,保持肉制品的结构和营养价值;但是过量摄入会导致中毒。某化学兴趣小组对亚硝酸钠进行多角度探究:(1)、I.亚硝酸钠的制备
实验中用恒压滴液漏斗,相比普通分液漏斗,其显著优点是。
(2)、D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为。(3)、II.探究亚硝酸钠与硫酸反应生成的气体产物已知:①NO+NO2+2OH-=2NO +H2O ②气体液化的温度:NO2:21℃,NO:-152℃
反应前应打开弹簧夹,先通入一段时间氮气,其目的是。
(4)、为了检验装置A中生成的气体产物,装置的连接顺序(从左→右连接):A、C、、、。 (5)、关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
(5)、关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。①确认A中产生的气体含有NO,依据的现象是。
②装置E的作用是。
③通过上述实验探究过程,可得出装置A中反应的化学方程式为。
(6)、III.设计实验证明酸性条件下NaNO2具有氧化性供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:。
10. 碘及碘的化合物在人类活动中占有重要的地位。已知反应H2(g)+I2(g) 2HI(g)ΔH=-14.9kJ·mol-1。(1)、根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为kJ。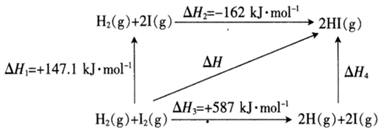 (2)、氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
(2)、氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示: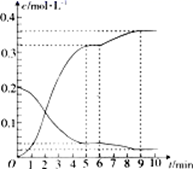
0~5min内,用H2(g)表示的该反应速率v(H2)=。6min时,改变的外界条件为。
(3)、反应H2(g)+I2(g) 2HI(g)的反应机理如下:第一步:I2 2I(快速平衡);
第二步:I+H2 H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由步决定。
(4)、将等物质的量的I2和H2置于预先抽真空的特制1L恒容密闭容器中,加热到1500K,起始总压强为416kPa;体系达到平衡时,总压强为456kPa。若体系中只考虑如下反应关系:①I2(g) 2I(g)Kpl=200ΔH1
②I2(g)+H2(g) 2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为kPa,Kp2=(写表达式)。
(5)、某实验兴趣小组将氧化还原反应2Cu2++5I- 2CuI↓++ 设计成如图所示的原电池装置: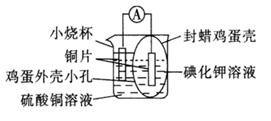
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为(填“正极”或“负极”);该电极反应式为。
11. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:(1)、 的价电子排布图为:;基态磷原子有种空间运动状态不同的电子。(2)、Li、O、P三种元素的电负性由大到小的顺序是:。(3)、写出一种与 互为等电子体的分子的化学式: , 该分子的中心原子的价层电子对数等于。(4)、已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:。A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)、N和P是同主族元素,但是 分子中的键角大于 分子中的键角,原因是:。(6)、 为离子晶体,具有反萤石结构,晶胞如下图所示。则 配位数为: , 若晶胞参数为bnm,阿伏加德罗常数的值为 ,则 的密度为 (列出计算式即可)。 12. 化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H及合成橡胶(N)的合成路线。
12. 化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H及合成橡胶(N)的合成路线。 (1)、A的结构简式是。(2)、写出反应类型:G→H;写出反应条件:D→E。(3)、写出B→C化学反应方程式:;(4)、写出E+F→N化学反应方程式:。(5)、H在一定条件下能被氧化为不饱和酸
(1)、A的结构简式是。(2)、写出反应类型:G→H;写出反应条件:D→E。(3)、写出B→C化学反应方程式:;(4)、写出E+F→N化学反应方程式:。(5)、H在一定条件下能被氧化为不饱和酸 ,该不饱和酸有多种同分异构体,属于酸类且含有碳碳双键的同分异构体共有__种。 (6)、已知:①RCHO
,该不饱和酸有多种同分异构体,属于酸类且含有碳碳双键的同分异构体共有__种。 (6)、已知:①RCHO
②

③
 +SOCl2→
+SOCl2→  +SO2+HCl;R-OH+SOCl2→R-Cl+SO2+HCl
+SO2+HCl;R-OH+SOCl2→R-Cl+SO2+HCl根据已有知识并结合相关信息,写出以
 为原料制备
为原料制备  的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: 。
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: 。