江西省上饶市2021年高考化学二模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 下列说法正确的是( )A、“春蚕到死丝方尽,蜡炬成灰泪始干。”古代的蜡是高级脂肪酸酯,属于高分子化合物 B、造纸是中国四大发明之一,古代造纸有六个步骤:斩竹漂塘、煮楻足火、舂臼打烂、荡料入帘、覆帘压纸、透火焙干都属于物理变化 C、干雾过氧化氢空气消毒机在新冠抗疫中被广泛使用,其原理是利用过氧化氢的氧化性 D、经分析嫦娥四号采样返回器带回的月球矿物含有 CaO·MgO·2SiO2 , 该物质属于氧化物2. 中国工程院院士李兰娟团队于 2021年2 月4日公布治疗新型冠状病毒肺炎的最新研究成果:“达芦那韦”是抗击新型冠状病毒潜在用药,合成“达芦那韦”的部分路线如图所示,下列说法错误的是( )
 A、C的分子式为C11H15N B、B的同分异构体有7种(不含B,不考虑立体异构) C、D分子中的所有碳原子不可能处于同一平面 D、反应①为加成反应,反应②为取代反应3. 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号主族元素且原子序数依次增大,Z与Q同主族,Q 和W的简单离子具有相同的电子层结构,下列说法错误的是( )
A、C的分子式为C11H15N B、B的同分异构体有7种(不含B,不考虑立体异构) C、D分子中的所有碳原子不可能处于同一平面 D、反应①为加成反应,反应②为取代反应3. 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号主族元素且原子序数依次增大,Z与Q同主族,Q 和W的简单离子具有相同的电子层结构,下列说法错误的是( ) A、简单离子半径:W<Q B、最简单氢化物的沸点:Q<Z C、化合物YZ2与YZQ分子结构相似 D、X、Y、Z形成的化合物的水溶液一定显酸性4. 由下列实验操作及现象推出的相应结论正确的是( )
A、简单离子半径:W<Q B、最简单氢化物的沸点:Q<Z C、化合物YZ2与YZQ分子结构相似 D、X、Y、Z形成的化合物的水溶液一定显酸性4. 由下列实验操作及现象推出的相应结论正确的是( )选项
实验操作
现象
结论
A
向两份蛋白质溶液中分别滴加饱和氯化钠溶液和饱和硫酸铜溶液
均有固体析出
蛋白质均发生变性
B
取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min分钟后取少量溶液于一洁净的试管中,加入新制Cu(OH)2溶液,加热
无砖红色沉淀产生
蔗糖没有发生水解
C
用c(Fe3+)相同的Fe2(SO4)3和FeCl3溶液,分别清洗做完银镜反应的试管
用FeCl3溶液清洗较干净
Fe3++Ag Ag++Fe2+是可逆反应,且AgCl更难溶于水
D
对于二氧化氮和四氧化二氮的平衡体系,缩小容器体积
混合气体颜色逐渐加深
符合勒夏特列原理
A、A B、B C、C D、D5. 磷及其化合物在工农业生产中具有重要用途,下图所示为提纯白磷样品(含惰性杂质)的工艺流程。下列说法错误的是( ) A、过程I中,被氧化的元素是Cu和P B、过程II 中,反应物的比例不同可获得不同产物,除Ca3(PO4)2和H2O外,可能还有Ca(H2PO4)2、CaHPO4 C、过程Ⅲ的化学方程式为2Ca3(PO4)2 +6SiO2+10C =6CaSiO3+10CO↑+P4 D、不慎将白磷沾到皮肤上,可用 0.2 mol·L-1CuSO4溶液冲洗6. 高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。如图为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。下列说法正确的是( )
A、过程I中,被氧化的元素是Cu和P B、过程II 中,反应物的比例不同可获得不同产物,除Ca3(PO4)2和H2O外,可能还有Ca(H2PO4)2、CaHPO4 C、过程Ⅲ的化学方程式为2Ca3(PO4)2 +6SiO2+10C =6CaSiO3+10CO↑+P4 D、不慎将白磷沾到皮肤上,可用 0.2 mol·L-1CuSO4溶液冲洗6. 高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。如图为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。下列说法正确的是( ) A、该电池放电时的总反应为Fe + FeO + 2H+ + 2H2O =2Fe(OH)3 B、放电时,此盐桥中阴离子的运动方向是从右向左 C、该电池充电时阳极反应的电极反应方程式为 FeO + 3e- + 4H2O = 2Fe(OH)3 + 5OH- D、每消耗56 g Fe,转移电子6 mol7. 25℃时,向Na2CO3溶液中滴入盐酸,不考虑溶液温度的变化,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX= 或 ,下列叙述正确的是( )
A、该电池放电时的总反应为Fe + FeO + 2H+ + 2H2O =2Fe(OH)3 B、放电时,此盐桥中阴离子的运动方向是从右向左 C、该电池充电时阳极反应的电极反应方程式为 FeO + 3e- + 4H2O = 2Fe(OH)3 + 5OH- D、每消耗56 g Fe,转移电子6 mol7. 25℃时,向Na2CO3溶液中滴入盐酸,不考虑溶液温度的变化,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX= 或 ,下列叙述正确的是( ) A、曲线m表示pH与 的变化关系 B、当溶液呈中性时c(Na+)=c(HCO ) + 2c(CO ) C、Ka1(H2CO3)=1.0×10-10.3 D、25℃时,CO +H2O⇌HCO +OH-的平衡常数为1.0×10-3.7
A、曲线m表示pH与 的变化关系 B、当溶液呈中性时c(Na+)=c(HCO ) + 2c(CO ) C、Ka1(H2CO3)=1.0×10-10.3 D、25℃时,CO +H2O⇌HCO +OH-的平衡常数为1.0×10-3.7二、非选择题
-
8. 在活性炭催化下,用CoCl2、NH4Cl、H2O2、浓氨水为原料可生成橙黄色晶体X。为测定其组成,进行如下实验。
I、氨的测定:精确称取wgX,加入适量的水溶解,注入如图所示的三颈瓶(B)中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1NaOH标准溶液滴定过剩的盐酸,到终点时消耗V2mLNaOH溶液。

II、氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀。
回答下列问题:
(1)、A中安全管的作用是。(2)、仪器a的名称是 , C装置冰盐水的作用是。(3)、在NaOH标准溶液滴定过剩的盐酸实验中,锥形瓶中应加入几滴(填“石蕊”或“酚酞”或“甲基橙”)作指示剂。若在滴定前滴定管尖嘴内有气泡,滴定后气泡消失,则测得的样品中氨的含量会(填“偏高”或“偏低”或“不变”)。样品中氮的质量分数表达式为。(4)、测定氯的过程中,滴定终点的现象为。(5)、经测定,样品X的化学式为Co(NH3)6Cl3 , 写出制备X的化学方程式:。X的制备过程中,X产率与温度的关系如图所示,当温度高于T1时X的产率下降,原因是。(写一点) 9. 工业上利用钴渣[主要成分为Co2O3、Co(OH)3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制备钴氧化物的工艺流程如下。
9. 工业上利用钴渣[主要成分为Co2O3、Co(OH)3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制备钴氧化物的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表。
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
完全沉淀
3.7
9.6
9.2
5.2
9.8
(1)、钴的浸出率随酸浸时间、温度的变化关系如图1,应选择的最佳工艺条件为。金属离子在萃取剂中的萃取率随pH变化关系如图2,据此分析pH的最佳范围是。A.5~5.5 B.4~4.5 C.3~3.5 D.2~2.5
 (2)、Fe2+、Co2+、 SO 三种离子的还原性由强到弱的顺序是。氧化过程中加NaClO3被还原,产物中的氯元素处在最低价态,反应的离子方程式为。(3)、25℃ Ksp(MgF2)=7.4×10-11 , Ksp(CaF2)=1.5×10-10。除钙、镁工艺中加过量NaF溶液,滤液中 =(保留两位有效数字)。(4)、已知常温下Kb(NH3·H2O)=1.8×10-5 , Kh(C2O )=1.8×10-10 , (NH4)2C2O4溶液显(填“酸性” 或“中性”或“碱性”)。在“萃后余液”中加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时应选用的试剂为(填字母代号)。
(2)、Fe2+、Co2+、 SO 三种离子的还原性由强到弱的顺序是。氧化过程中加NaClO3被还原,产物中的氯元素处在最低价态,反应的离子方程式为。(3)、25℃ Ksp(MgF2)=7.4×10-11 , Ksp(CaF2)=1.5×10-10。除钙、镁工艺中加过量NaF溶液,滤液中 =(保留两位有效数字)。(4)、已知常温下Kb(NH3·H2O)=1.8×10-5 , Kh(C2O )=1.8×10-10 , (NH4)2C2O4溶液显(填“酸性” 或“中性”或“碱性”)。在“萃后余液”中加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时应选用的试剂为(填字母代号)。A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)、取一定质量煅烧后产生的钴氧化物(Co为+2、+3价),用100 mL 8 mol·L-1的盐酸恰好完全溶解,得到CoCl2溶液和标准状况2.24 L黄绿色气体。则该钴氧化物中+2价的Co与+3价Co元素的物质的量之比为。10. 上饶市正在创建“全国文明城市”,对碳的化合物做广泛深入的研究并妥善处理具有重要意义。(1)、I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示: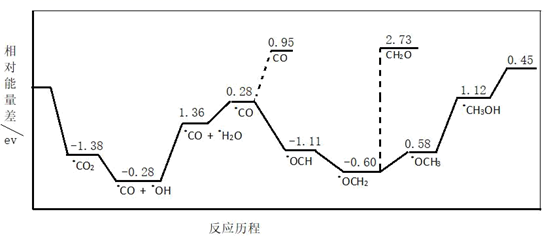
容易得到的副产物有CO和CH2O,其中相对较少的副产物为;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中(填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO •OCH
C.•OCH2 •OCH3 D.•CO + •OH •CO + •H2O
(2)、II.天然气一个重要的用途是制取H2 , 其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2 , 在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。
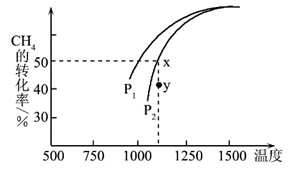
y点:v(CO)正v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=Pa2。
(3)、天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:。(4)、III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。
电池工作过程中,阴极的电极反应式为。
(5)、每转移0.2mol电子,阳极室溶液质量减少g。11. 2019年诺贝尔化学奖授予约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰等三位科学家,以表彰他们在锂电池研究作出的卓越贡献。常用的锂电池用镍钴锰酸锂Li(NiCoMn)O2或磷酸铁锂(LiFePO4)等为正极材料。请回答下列问题:(1)、Ni在元素周期表的位置是区(填分区),基态Fe原子的价电子排布式为。(2)、1 mol配合物[Co(NH3)4Cl2]Cl含σ键数目为NA。(3)、磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3 , 这四种酸中酸性最强的是 , HPO3中心原子的杂化方式是 , 写出与PO 互为等电子体的离子(写离子符号,任写两个)。(4)、硫化锂 Li2S 的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若a处微粒的坐标是 则b处微粒的坐标是;S2-的配位数是;若硫化锂晶体的密度为ρ g·cm-3 , 则Li+与S2- 的最短距离是nm(用含ρ、NA的计算式表示)。 12. 化合物G是重要的药物中间体,以有机物 A为原料制备G,其合成路线如下:
12. 化合物G是重要的药物中间体,以有机物 A为原料制备G,其合成路线如下: 回答下列问题:(1)、D中官能团的名称为。(2)、D→E的反应类型为。(3)、G的分子式为。(4)、E→F的反应方程式为(不要求写出反应条件)。(5)、已知A:①能与FeCl3溶液发生显色反应且不能发生银镜反应;②苯环上有两个取代基且苯环上的一氯代物只有两种。则A的结构简式为。(6)、H是E的同系物,比E少一个碳原子,H可能的结构有种(不考虑立体异构)。(7)、参考上述合成线路,写出以1-丙醇、丙二酸二甲酯(CH3OOCCH2COOCH3)、尿素[CO(NH2)2]为起始原料制备
回答下列问题:(1)、D中官能团的名称为。(2)、D→E的反应类型为。(3)、G的分子式为。(4)、E→F的反应方程式为(不要求写出反应条件)。(5)、已知A:①能与FeCl3溶液发生显色反应且不能发生银镜反应;②苯环上有两个取代基且苯环上的一氯代物只有两种。则A的结构简式为。(6)、H是E的同系物,比E少一个碳原子,H可能的结构有种(不考虑立体异构)。(7)、参考上述合成线路,写出以1-丙醇、丙二酸二甲酯(CH3OOCCH2COOCH3)、尿素[CO(NH2)2]为起始原料制备 的合成线路 (其它试剂任选)。
的合成线路 (其它试剂任选)。