江西省萍乡市2021年高考化学二模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 2020年11月24日凌晨,嫦娥5号在长征5号火箭巨大的推力下,启程前往月球,经20多天旅程后带着月壤返回,这是中国航天“探月工程”向世界展示出“中国力量”。下列相关说法正确的是( )A、“嫦娥5号”使用的太阳能电池和锂离子电池均是将化学能转化为电能的装置 B、“返回器减速伞”用的材料——高强度锦纶纤维,属于天然高分子材料 C、“嫦娥5号”带回的“快递”——月壤中含有珍贵的3He,它与4He互为同素异形体 D、长征5号火箭采用“液氢液氧”作为推进剂,“液氢”属于绿色环保燃料2. 如图①、②、③三种物质的分子式均为C9H12。下列说法正确的是( )
 A、①和③都能使Br2的CCl4溶液或酸性KMnO4溶液褪色 B、等物质的量的①与②分别与足量的H2反应,消耗的H2一样多 C、③能发生取代反应,加成反应和氧化反应 D、①的一氯代物有6种3. 已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( )
A、①和③都能使Br2的CCl4溶液或酸性KMnO4溶液褪色 B、等物质的量的①与②分别与足量的H2反应,消耗的H2一样多 C、③能发生取代反应,加成反应和氧化反应 D、①的一氯代物有6种3. 已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( ) A、化合物X高温下有较强稳定性 B、A,B,E均可与C形成常见的两种二元化合物 C、简单离子的半径:E>C>D>A D、简单氢化物的沸点:C>E4. 下列实验操作、现象及得出的结论均正确的是( )
A、化合物X高温下有较强稳定性 B、A,B,E均可与C形成常见的两种二元化合物 C、简单离子的半径:E>C>D>A D、简单氢化物的沸点:C>E4. 下列实验操作、现象及得出的结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向Na2S溶液中滴加盐酸
产生臭鸡蛋气味气体
非金属性:Cl>S
B
将相同大小的金属钠分别投入乙醇和水中
乙醇与钠反应缓慢,水与钠反应剧烈
乙醇羟基中的氢原子不如水分子中的氢原子活泼
C
白铁皮镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生氧化还原反应
D
室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2CO3和NaHSO3两种溶液的pH
pH:Na2SO3>NaHSO3
HSO 结合H+能力比SO 的强
A、A B、B C、C D、D5. 工业上采用NH3和O2在钒基催化剂表面协同脱除烟气中的NO,一种反应过程如图所示,下列叙述正确的是( ) A、V5+—O-…H—N+H3是催化剂 B、整个过程中V的化合价未发生变化 C、反应过程中有极性键和非极性键的断裂和形成 D、总反应的化学方程式为4NH3+2O2+2NO=3N2+6H2O6. 新型可充电钠离子电池因具有原料储量丰富,价格低廉,安全性高等优点而备受青睐,而Fe[Fe(CN)6]因理论比容量较高,充放电过程中材料结构稳定,有利于Na的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法错误的是( )
A、V5+—O-…H—N+H3是催化剂 B、整个过程中V的化合价未发生变化 C、反应过程中有极性键和非极性键的断裂和形成 D、总反应的化学方程式为4NH3+2O2+2NO=3N2+6H2O6. 新型可充电钠离子电池因具有原料储量丰富,价格低廉,安全性高等优点而备受青睐,而Fe[Fe(CN)6]因理论比容量较高,充放电过程中材料结构稳定,有利于Na的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法错误的是( )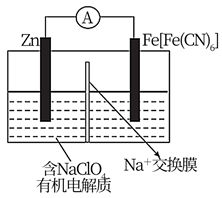 A、充电时,锌片应该与电源的负极相连 B、放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] C、放电时,外电路中通过0.2mol电子时,有0.1molZn(ClO4)2生成 D、对于正极材料,放电可实现Na+的脱嵌,充电可实现Na+的嵌入7. 化学中常用AG表示溶液的酸度(AG=lg 。室温下,向20.00mL01000mL·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是( )
A、充电时,锌片应该与电源的负极相连 B、放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] C、放电时,外电路中通过0.2mol电子时,有0.1molZn(ClO4)2生成 D、对于正极材料,放电可实现Na+的脱嵌,充电可实现Na+的嵌入7. 化学中常用AG表示溶液的酸度(AG=lg 。室温下,向20.00mL01000mL·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是( ) A、b、c、d三点对应的溶液中,水的电离程度大小为b=d>c B、b点对应的溶液中:c(M+)-c(MOH)=2c(OH-)-2c(H+) C、当AG=0时,溶液中存在c(SO )>c(M+)>c(H+)=c(OH-) D、室温下M+的水解常数Kh=10×10-5
A、b、c、d三点对应的溶液中,水的电离程度大小为b=d>c B、b点对应的溶液中:c(M+)-c(MOH)=2c(OH-)-2c(H+) C、当AG=0时,溶液中存在c(SO )>c(M+)>c(H+)=c(OH-) D、室温下M+的水解常数Kh=10×10-5二、非选择题
-
8. 二氯化钒(VCl2)有强吸湿性和强还原性,熔点为425℃、沸点900℃,是制备多种医药、催化剂、含钒化合物的中间体。有以下两种方案制备VCl2:
方案一:V2O5 VCl2溶液
方案二:在800℃的N2流中VCl3分解
(1)、请写出方案一的化学方程式:。(2)、某学习小组在实验室用方案二制备VCl2并检验其气体产物Cl2。
请回答下列问题:
①按气流方向,上述装置合理的连接顺序为A→(用大写字母填空)。
②焦性没食子酸溶液的作用是。
③实验过程中需持续通入空气,其作用为。
④实验后,选用D中所得溶液和其他合理试剂,设计实验方案证明C处有Cl2生成。
(3)、测定产品纯度:实验后产品中只混有少量VCl3杂质。称量1.3775g样品,充分溶于水中,调pH后滴加Na2CrO4作指示剂,用0.500mol·L-1AgNO3标准溶液滴定Cl- , 达到滴定终点时消耗标准液体积为46.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。①滴定终点的现象为。
②产品中VCl2的物质的量分数为。(保留3位有效数字)
(4)、钒元素的常见离子有V2+、V3+、VO2+、VO ,小组同学进一步用如图所示装置验证还原性V2+强于VO2+。接通电路后,能观察到的实验现象是。 9. 锰酸锂(LiMn2O4)是新一代锂离子电池的正极材料。实验室回收利用废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)的一种流程如图:
9. 锰酸锂(LiMn2O4)是新一代锂离子电池的正极材料。实验室回收利用废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)的一种流程如图:
已知:Li2CO3在不同温度下的溶解度
温度/℃
0
10
20
50
75
100
Li2CO3
1.593
1.406
1.329
1.181
0.866
0.728
(1)、第①步反应中会有气体生成,该气体为: , 若要增大第①步反应的浸取率,可以采取的措施有: (写两条)。(2)、第②步反应得到的沉淀X的化学式为 , 上述流程中四步实验都包含过滤,实验室过滤时要使用的玻璃仪器有:。(3)、工业上洗涤Li2CO3用的是热水而不是冷水,其原因是。(4)、写出第③步反应“酸溶”过程中反应的离子方程式:。(5)、固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3-5小时,然后高温加热,保温24小时,冷却至室温。①写出该反应的化学方程式:。
②LiMn2O4中锰元素的平均价态为+3.5。在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见表。
T/℃
w(Mn2+)(%)
w(Mn3+)(%)
w(Mn4+)(%)
700
5.56
44.58
49.86
750
2.56
44.87
52.57
800
5.50
44.17
50.33
850
6.22
44.40
49.38
由此可以确定:在上述温度范围内,锰元素的平均价态的变化趋势是:随温度升高(填选项)
A.增大 B减小 C.先增大后减小 D.先减小后增大
10. C1(分子中含一个C的物质如CO、CO2、CH4、CH3OH等)分子的选择性催化转化可制备高附加值化学品(如合成气和清洁能源如氢气)。对解决当前日益严峻的能源短缺和气候变化等问题具有积极意义,已知在催化剂的表面可发生如下反应:(1)、甲醇分解:①CH3OH(g) CO(g)+2H2(g) △H1= +90.64 kJ•mol-1;水蒸气变换:②CO(g)+H2O(g) CO2(g)+H2(g) △H2
a.对于甲醇分解反应正反应活化能E1与逆反应活化能E2 , 其E1E2(填“>”或“<”)。
b.已知有关物质的摩尔生成熔(由元素最稳定的单质生成1mol纯化合物时的反应热)加如下:CO(g):-110.53 kJ/mol,CO2(g):-393.5 kJ/mol,H2O(g):-241.8 kJ/mol,H2(g):-0 kJ/mol;则△H2=。
(2)、573.2 K时,向一恒容密闭容器中按n(CH3OH):n(H2O)=1:1.2充入混合气体,已知CH3OH的起始压强为5.00 MPa,t h后达平衡时,CH3OH的转化率为60%,CO2的选择性为40%(选择性:转化的CH3OH中最终生成CO2和CO的百分比),则t h内v(CH3OH)=MPa﹒h-1(用含t的代数式表示),反应①的分压平衡常数Kp=(MPa)2。(3)、由于CO分子极难被活化,水煤气变换反应催化转化过程往往受热力学和反应动力学控制,通常工业上要求高温高压等苛刻反应条件,而低温等离子体催化能够在气相中快速活化CO分子,实现低温常压下高选择性地转化CO,下列关于水煤气变换反应的说法正确___。A、催化剂能有效降低反应的活化能,但不能增大反应物中活化分子的百分数 B、相对于通常方法,工业上选择低温等离子体催化剂能有效提高反应速率和CO的平衡转化率 C、选择低温等离子体催化剂能有效的解决高能耗和催化剂易失活等关键问题 D、工业上通入的H2O(g)越多生成物的百分含量越高(4)、在0.1 MPa下,将总进料量为1 mol且n(CH3OH):n(H2O)=1:1.2的混合气体充入一刚性密闭容器中进行反应。平衡时,测得CH3OH在给定温度范围内含量极小,H2、H2O(g)、CO、CO2四种组分的含量变化与反应温度的关系如图所示,曲线a、d对应物质的化学式分别为、。 11. 镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。请回答下列问题:(1)、基态镍原子有个未成对电子,基态Fe3+有种不同运动状态的电子,铬的基态原子核外价层电子排布式为。(2)、配离子[Cr(H2O)6] 3+中,与Cr3+形成配位键的原子是(填元素符号),铬的高价化合物可将CH3CH2OH氧化为CH3CHO,CH3CHO中碳原子的杂化方式分别为、。(3)、镍能与CO形成Ni(CO)4 , 常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为(填元素符号),CO分子中π键与σ键的个数比为。(4)、已知NiO晶体的密度为ρg·cm-3 , Ni2-和O3-的半径分别为r1pm和r2pm,阿伏加德罗常数的值为NA , 则该晶胞中粒子的体积占晶胞体积的百分率为。
11. 镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。请回答下列问题:(1)、基态镍原子有个未成对电子,基态Fe3+有种不同运动状态的电子,铬的基态原子核外价层电子排布式为。(2)、配离子[Cr(H2O)6] 3+中,与Cr3+形成配位键的原子是(填元素符号),铬的高价化合物可将CH3CH2OH氧化为CH3CHO,CH3CHO中碳原子的杂化方式分别为、。(3)、镍能与CO形成Ni(CO)4 , 常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为(填元素符号),CO分子中π键与σ键的个数比为。(4)、已知NiO晶体的密度为ρg·cm-3 , Ni2-和O3-的半径分别为r1pm和r2pm,阿伏加德罗常数的值为NA , 则该晶胞中粒子的体积占晶胞体积的百分率为。 12.
12.
已知:R—Cl+
 →
→  (R1、R2烃为基或H)(1)、B的化学名称为 , 反应②⑤的反应类型分别为 , 。(2)、反应②的化学方程式为。(3)、D的结构简式为。(4)、A的同分异构体中,满足下列条件的有种。
(R1、R2烃为基或H)(1)、B的化学名称为 , 反应②⑤的反应类型分别为 , 。(2)、反应②的化学方程式为。(3)、D的结构简式为。(4)、A的同分异构体中,满足下列条件的有种。①含苯环且遇氯化铁溶液显紫色
②苯环上连有2个取代基,且苯环上的一氯代物有2种
③含有—N—H,且不含N—N结构
其中核磁共振氢谱为4:3:2:2:1的结构简式为。
(5)、以 、H2C=CH2为基本原料合成
、H2C=CH2为基本原料合成  (其他无机试剂任选)。
(其他无机试剂任选)。