江西省南昌市2021年高考化学三模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 央视《典籍里的中国》因袁隆平、宋应星两位科学家跨越时空的“握手”被刷上热搜。宋应星所著《天工开物》被誉为“百科全书之祖”。下列说法错误的是( )A、“凡播种先以稻麦稿包浸数日俟其生芽撒于田中生出寸许其名曰秧。”。其中“稻麦稿”的主要成分纤维素。 B、“水火既济而土合······后世方土效灵人工表异陶成雅器有素肌、玉骨之象焉”以上所述的“陶成雅器”的主要原料是黏土、石灰石 C、“凡火药,硫为纯阳,硝为纯阴,此乾坤幻出神物也”,“硝”指的是硝酸钾。 D、“凡铸镜模用灰沙铜用锡和”该法所制铜镜主要成分为青铜。2. 设NA为阿伏加德罗常数的值下列有关叙述正确的是( )A、100mL1mol·L-1NH4Cl溶液中含有阳离子的数目小于0.1NA B、0.5L0.5mol·L-1醋酸溶液中含有的分子数目小于0.25NA C、60gSiO2晶体中含有[SiO4]四面体结构单元的数目为NA D、25℃时Ksp(CaSO4)=9×10-6 , 则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+3. 中医药在抗击新冠肺炎疫情中发挥了重要作用,有些中医药对其他的病症也有着独特的疗效,以下成分(结构如图)对肿瘤细胞的杀伤有独特作用。下列有关该物质的叙述错误的是( )
 A、该物质有4种官能团 B、分子中苯环上的一氯代物只有4种 C、可以发生取代反应、加成反应、氧化反应、还原反应 D、1 mol该物质与溴水反应,最多消耗1 mol Br24. 根据下列实验操作和现象所得到的结论正确的是( )
A、该物质有4种官能团 B、分子中苯环上的一氯代物只有4种 C、可以发生取代反应、加成反应、氧化反应、还原反应 D、1 mol该物质与溴水反应,最多消耗1 mol Br24. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
B
室温下,向 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升
镁与盐酸反应放热
C
室温下,向浓度均为 的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀
白色沉淀是BaCO3
D
向 H2O2溶液中滴加 KMnO4溶液,溶液褪色
H2O2具有氧化性
A、A B、B C、C D、D5. X、Y、Z、Q、R是位于同一短周期的元素,它们组成的化合物结构如图所示,X、R的最外层电子数之和等于Q的核电荷数。下列叙述中正确的是( ) A、简单离子半径:X<Q<R B、最简单氢化物的稳定性:Q<R C、最高价氧化物的水化物的酸性:R>Z>Y D、该化合物中所有原子均满足8电子稳定结构6. COOH燃料电池的装置如下图,两电极间用允许K+和H+通过的半透膜隔开。下列说法错误的是( )
A、简单离子半径:X<Q<R B、最简单氢化物的稳定性:Q<R C、最高价氧化物的水化物的酸性:R>Z>Y D、该化合物中所有原子均满足8电子稳定结构6. COOH燃料电池的装置如下图,两电极间用允许K+和H+通过的半透膜隔开。下列说法错误的是( ) A、电池工作时,电子由a电极经外电路流向b电极 B、负极的电极反应式为HCOO-+2OH-_2e-=HCO +H2O C、理论上每消耗标准状况下22.4LO2 , 有2molK+通过半透膜 D、通入O2发生的反应为4Fe2++4H++O2=4Fe3++2H2O7. 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下PbCO3和PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc( )或-lgc(I-)的关系如图所示。下列说法正确的是( )
A、电池工作时,电子由a电极经外电路流向b电极 B、负极的电极反应式为HCOO-+2OH-_2e-=HCO +H2O C、理论上每消耗标准状况下22.4LO2 , 有2molK+通过半透膜 D、通入O2发生的反应为4Fe2++4H++O2=4Fe3++2H2O7. 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下PbCO3和PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc( )或-lgc(I-)的关系如图所示。下列说法正确的是( ) A、Ksp(PbCO3)的数量级为10-14 B、p点对应的是PbCO3不饱和溶液 C、L2对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 D、向浓度相同的Na2CO3、Nal混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀
A、Ksp(PbCO3)的数量级为10-14 B、p点对应的是PbCO3不饱和溶液 C、L2对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 D、向浓度相同的Na2CO3、Nal混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀二、非选择题
-
8. 连二亚硫酸钠(Na2S2O4)也称为保险粉,在空气中极易被氧化,不溶于乙醇易溶于水,在碱性介质中较稳定,是用途广泛的无机精细化学品。某科研小组设计两种方法制备Na2S2O4。回答下列问题:(1)、电解NaHSO3溶液制备Na2S2O4 , 装置如图所示。

①X为(填化学式)。
②电极a的电极反应式为。
③装置若无阳离子交换膜(填“能”或“不能”)得到Na2S2O4。
(2)、锌粉法制备Na2S2O4 , 装置(部分夹持仪器已省略)如图所示。
①盛放浓硫酸的仪器名称为;写出装置A烧瓶内反应的化学方程式:。
②通入SO2前装置B的三颈烧瓶内应先通入N2 , 目的是。通入SO2 , 控制反应温度约为35℃,反应一段时间后再滴加NaOH溶液将有Na2S2O4和Zn(OH)2生成。控制反应温度约为35℃的方法是 , 写出生成Na2S2O4和Zn(OH)2总反应离子方程式:。
③将反应后的悬浊液过滤后在微热下加入氯化钠冷却至20℃,析出Na2S2O4结晶过滤后,再用乙醇洗涤几次后,置于真空干燥箱中干燥即得到Na2S2O4。简述用乙醇洗涤的原因:。
(3)、产品中Na2S2O4纯度的测定。称取mgNa2S2O4样品溶于冷水中配成100mL溶液,取出10mL该溶液置于预先盛有20mL中性甲醛溶液的烧杯中,搅拌至完全溶解,转移至250mL容量瓶中用水稀释至刻度摇匀。移取25mL该溶液于250mL锥形瓶中加入4mL盐酸溶液,用cmol·L-1的碘标准溶液滴定,近终点时加入3mL淀粉溶液继续滴定,至溶液呈浅蓝色在30s内颜色不消失,用去碘标准溶液VmL。产品中Na2S2O4的质量分数为。
已知:Na2S2O4+2CH2O+H2O=NaHSO3∙CH2O+NaHSO2∙CH2O
NaHSO2∙CH2O+2I2+2H2O=NaHSO4+CH2O+4HI
9. 三氧化钨(WO3)常用于制备特种合金、防火材料和防腐涂层。现利用白钨精矿(含80%CaWO4及少量Fe、Zn和Mg等的氧化物)生产WO3 , 设计了如下工艺流程:
已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5 , Ksp(CaC2O4)=2.3×10-9;
Ka1(H2C2O4)=5.6×10-2 , Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
(1)、“破碎”的目的是;“破碎”后的白钨精矿粒径约为50μm,往其中加入浸取液后形成的分散系属于。(2)、操作I的名称为。(3)、浸出液中含量最大的阳离子是;[WO3C2O4H2O]2-中W元素的化合价为。(4)、“加热”时发生反应的离子方程式为;“煅烧”时发生反应的化学方程式为。(5)、本工艺中能循环使用的物质是。(6)、通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:。10. “化学链燃烧技术”可以提高燃料的燃烧效率,其基本原理是借助载氧剂(如金属氧化物等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气不用接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:(1)、CH4用NiO作载氧体的化学链燃烧示意图如下:
主要热化学反应如下:
I.2Ni(s)+O2(g)=2NiO(s) ∆H=-479.8kJ∙mol-1
II.CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ∆H=+68.9kJ∙mol-1
①CH4的燃烧热是。
②与直接燃烧CH4相比“化学链燃烧”的优点为。
a.燃烧等质量的CH4 , 放出的热量多
b.有利用于二氧化碳的分离与回收
c.燃烧等质量的CH4 , 消耗的O2少
(2)、用FeO作载氧剂部分反应的lgKp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压(平衡分压=总压x物质的量分数)代替平衡浓度]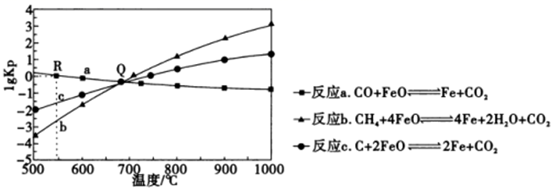
①R点对应温度下向某恒容密闭容器中通入1.0molCO和0.2molCO2 , 并加入足量的FeO,只发生反应a:CO(g)+FeO(s)=CO2(g)+Fe(s),则CO的平衡转化率为。
②若某恒容密闭容器中只发生反应b和c,平衡时对应上图中Q处时,容器中气体分压p(X)间应满足的关系是。
(3)、在T℃下,向某恒容密闭容器中加入1molCH4(g)和足量的FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为Po , 达到平衡状态时容器的气体压强是起始压强的2倍。①T℃下该反应的Kp=。
②其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率(填“增大”“减小”或“不变”)。
(4)、利用电解装置可实现CH4和CO2两种分子的耦合转化其原理如图所示。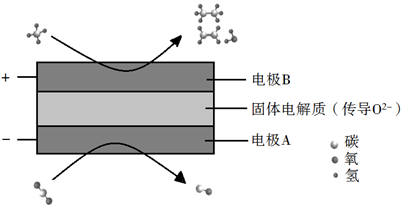
①写出生成乙烯的电极反应式为:。
②若生成的乙烯和乙烷的体积比为1:2,则消耗的CH4和CO2体积比为。
11. 下图为钠的某种氧化物D的晶胞和H3BO3(层状结构)的结构示意图。请回答下列问题: (1)、基态硼原子的电子排布图为:其第一电离能小于Be,原因是。(2)、三价B易形成多种配离子如[B(OH)4]-、BH 离子[B(OH)4]-的空间构型为。硼酸显弱酸性与该配离子有关写出硼酸的电离方程式。写出一种与BH 互为等电子体的分子的电子式。(3)、在硼酸的层状结构中B的杂化类型是层内存在的作用力有。(4)、D的化学式为;晶胞中O原子的配位数为;已知该晶体F的密度为dg·cm-3 , 晶胞参数a=nm。12. 有机化合物J在化工、医药、农林等领域有广泛的应用。实验室制备J的合成路线如下:
(1)、基态硼原子的电子排布图为:其第一电离能小于Be,原因是。(2)、三价B易形成多种配离子如[B(OH)4]-、BH 离子[B(OH)4]-的空间构型为。硼酸显弱酸性与该配离子有关写出硼酸的电离方程式。写出一种与BH 互为等电子体的分子的电子式。(3)、在硼酸的层状结构中B的杂化类型是层内存在的作用力有。(4)、D的化学式为;晶胞中O原子的配位数为;已知该晶体F的密度为dg·cm-3 , 晶胞参数a=nm。12. 有机化合物J在化工、医药、农林等领域有广泛的应用。实验室制备J的合成路线如下:
回答下列问题:
(1)、A的名称为;D中含有的官能团名称。(2)、反应G→H的化学方程式为其反应类型是。(3)、F的结构简式为。(4)、同时满足下列条件I的同分异构体有种。①苯环上只有2个取代基
②能与FeCl3溶液发生显色反应
③有3个甲基
写出其中核磁共振氢谱有5组峰峰面积比为1:1:2:2:9的同分异构体结构简式:。
(5)、根据题中信息设计以乙烯和 为原料制备1-丁烯的合成路线(无机试剂和有机溶剂任用合成路线示例见本题题干)。
为原料制备1-丁烯的合成路线(无机试剂和有机溶剂任用合成路线示例见本题题干)。