江苏省南通市2021年高考化学四模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 2021年5月15日,“天问一号”探测器成功软着陆于火星。这是中国火星探测史上的历史性事件。新型铝基碳化硅复合材料被大量应用于火星车的车身。下列关于该复合材料可能的性质描述错误的是( )
 A、密度小 B、硬度大 C、熔点低 D、抗氧化2. 甲硫醇(CH3SH)是合成蛋氨酸的重要原料。反应CH3OH+H2S CH3SH+H2O可用于甲硫醇的制备。下列有关说法正确的是( )A、Al3+的结构示意图为
A、密度小 B、硬度大 C、熔点低 D、抗氧化2. 甲硫醇(CH3SH)是合成蛋氨酸的重要原料。反应CH3OH+H2S CH3SH+H2O可用于甲硫醇的制备。下列有关说法正确的是( )A、Al3+的结构示意图为 B、H2S的电子式为H+
B、H2S的电子式为H+  H+
C、1 mol CH3SH中含6molσ键
D、CH3OH与CH3SH互为同系物
3. 氯是海水中重要的元素。下列有关氯及其化合物的性质与用途具有对应关系的是( )A、氯气显黄绿色,可用于制盐酸 B、盐酸呈强酸性,可用于除水垢 C、次氯酸具有弱酸性,可用作漂白剂 D、四氯化碳难溶于水,可用作灭火剂4. 镀锌铁皮可用于制备七水合硫酸锌(ZnSO4 7H2O),其流程如图。
H+
C、1 mol CH3SH中含6molσ键
D、CH3OH与CH3SH互为同系物
3. 氯是海水中重要的元素。下列有关氯及其化合物的性质与用途具有对应关系的是( )A、氯气显黄绿色,可用于制盐酸 B、盐酸呈强酸性,可用于除水垢 C、次氯酸具有弱酸性,可用作漂白剂 D、四氯化碳难溶于水,可用作灭火剂4. 镀锌铁皮可用于制备七水合硫酸锌(ZnSO4 7H2O),其流程如图。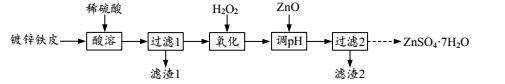
下列有关说法正确的是( )
A、镀锌铁皮的镀层被破坏后铁的腐蚀比生铁快 B、“氧化”发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O C、“调pH”后所得溶液中大量存在的离子有Zn2+、SO 、Fe3+、H+ D、从“过滤2”所得滤液中获取晶体的操作为:蒸发滤液至有大量晶体出现时停止加热,利用余热将液体蒸干5. X、Y、Z、W、R是周期表中的短周期主族元素,原子序数依次增大。Y原子的最外层有4个电子,且未成对电子数和W相等,R和X同主族,RX为离子化合物。下列说法正确的是( )A、简单离子半径:r(R)>r(Z)>r(W) B、元素电负性:Z>W>Y C、Y、Z最高价氧化物对应水化物的酸性:Y>Z D、W与R形成的化合物中可能含有共价键6. 硝酸是无色、易挥发、有刺激性气味的液体,具有强氧化性,浓硝酸见光易分解。下列有关硝酸的说法正确的是( )A、NO 的空间构型为三角锥形 B、浓硝酸保存在棕色带橡胶塞的试剂瓶中 C、用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生 D、常温下用铁制容器运输浓硝酸是因为铁与浓硝酸不反应7. 工业常采用氨氧化法制硝酸,主要工艺流程如图所示;在氧化炉中发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH<0,NH3和空气的混合气通入灼热的铂铑合金网,生成的NO与残余的O2继续反应生成NO2.将NO2通入水中可制得HNO3.吸收塔排放的尾气中含有少量的NO、NO2等氮氧化物。工业以石灰乳为试剂,采用气-液逆流接触法(尾气从处理设备的底部进入,石灰乳从设备顶部喷淋)处理尾气。下列有关硝酸工业制备说法错误的是( ) A、合成塔中使用催化剂,可以提高单位时间内N2的转化率 B、加压可以提高氧化炉中NH3的平衡转化率 C、吸收塔中鼓入过量的空气可以提高硝酸的产率 D、采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分8. 利用石墨电极电解HNO3和HNO2的混合溶液可获得较浓的硝酸。其工作原理如图所示。下列说法正确的是( )
A、合成塔中使用催化剂,可以提高单位时间内N2的转化率 B、加压可以提高氧化炉中NH3的平衡转化率 C、吸收塔中鼓入过量的空气可以提高硝酸的产率 D、采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分8. 利用石墨电极电解HNO3和HNO2的混合溶液可获得较浓的硝酸。其工作原理如图所示。下列说法正确的是( ) A、a为电源的正极 B、电解池中的离子交换膜应为阴离子交换膜 C、阳极的电极反应式为 D、每2mol离子通过离子交换膜,左室产生的气体X的体积为22.4L(标准状况)9. 反应2N2H4(1)+2NO2(g)=3N2(g)+4H2O(1)ΔH=-1135.7 kJ·mol可为火箭发射提供能量。下列有关该反应的说法正确的是( )A、反应消耗32gN2H4(1)放出1135.7kJ的能量 B、反应物中所有化学键键能之和大于生成物中所有化学键键能之和 C、每生成18g水,反应中转移电子物质的量为4mol D、常温下该反应可自发进行10. 氯化铁常用于污水处理等。该化合物是棕红色固体,易潮解,100℃时易升华。实验室可用氯气与金属铁反应制备无水氯化铁,实验装置如图所示。下列说法正确的是( )
A、a为电源的正极 B、电解池中的离子交换膜应为阴离子交换膜 C、阳极的电极反应式为 D、每2mol离子通过离子交换膜,左室产生的气体X的体积为22.4L(标准状况)9. 反应2N2H4(1)+2NO2(g)=3N2(g)+4H2O(1)ΔH=-1135.7 kJ·mol可为火箭发射提供能量。下列有关该反应的说法正确的是( )A、反应消耗32gN2H4(1)放出1135.7kJ的能量 B、反应物中所有化学键键能之和大于生成物中所有化学键键能之和 C、每生成18g水,反应中转移电子物质的量为4mol D、常温下该反应可自发进行10. 氯化铁常用于污水处理等。该化合物是棕红色固体,易潮解,100℃时易升华。实验室可用氯气与金属铁反应制备无水氯化铁,实验装置如图所示。下列说法正确的是( ) A、装置I中反应的离子方程式为MnO2+4HCl Mn2++Cl2↑+2Cl-+2H2O B、装置II洗气瓶中加入饱和NaHCO3以除去Cl2中的少量HCl C、装置III和装置IV洗气瓶中盛放的液体均为浓硫酸 D、装置V的作用是为了防止倒吸11. 化合物X是合成某种药物的中间体,其结构如图所示。下列有关化合物X的说法正确的是( )
A、装置I中反应的离子方程式为MnO2+4HCl Mn2++Cl2↑+2Cl-+2H2O B、装置II洗气瓶中加入饱和NaHCO3以除去Cl2中的少量HCl C、装置III和装置IV洗气瓶中盛放的液体均为浓硫酸 D、装置V的作用是为了防止倒吸11. 化合物X是合成某种药物的中间体,其结构如图所示。下列有关化合物X的说法正确的是( ) A、X分子中不存在手性碳原子 B、X分子中所有原子可能共平面 C、1molX最多能与7molH2发生加成反应 D、一定条件下,X可与HCHO发生缩聚反应12. NH4HCO3是重要的氮肥。室温下,通过下列实验探究NH4HCO3的性质。
A、X分子中不存在手性碳原子 B、X分子中所有原子可能共平面 C、1molX最多能与7molH2发生加成反应 D、一定条件下,X可与HCHO发生缩聚反应12. NH4HCO3是重要的氮肥。室温下,通过下列实验探究NH4HCO3的性质。实验
实验操作和现象
1
用pH试纸测定0.1mol/LNH4HCO3溶液的pH,测得pH约为8
2
向0.1mol/LNH4HCO3溶液中加入等体积的0.1mol/L的盐酸,有气体放出
3
向0.1mol/LNH4HCO3溶液逐滴加入0.1mol/LNaOH溶液,有刺激性气味气体放出
4
向0.1mol/LNH4HCO3溶液中加入FeSO4溶液,得到白色沉淀
下列说法正确的是( )
A、实验1溶液中:c(HCO )>c(NH ) B、实验2混合后的溶液中:c(NH )+c(NH3·H2O)=c(Cl-) C、实验3产生的气体能使湿润的蓝色石蕊试纸变红 D、实验4发生反应的离子方程式为Fe2++CO =FeCO3↓13. CO2催化加氢是碳中和的重要手段之一,以下是CO2加氢时发生的两个主要反应:反应I:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-165.0kJ·mol-1
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
在体积为VL的两个恒容密闭容器中,分别按表所示充入一定量的CO2和H2.平衡体系中 和 随温度变化关系如图所示。
容器
起始物质的量/mol
CO2
H2
甲
0.1
0.3
乙
1
3

下列有关说法正确的是( )
A、ΔH2<0 B、曲线b表示乙容器中 随温度的变化 C、M点对应H2的总转化率为66.7% D、590℃条件下反应10min,某容器中 =2.4.此时,反应II的V正>V逆二、非选择题
-
14. 铬铁矿主要成分为铬尖晶石(FeCr2O4),以铬铁矿为原料可制备Cr2(SO4)3溶液。铬铁矿的尖晶石结构在通常条件下难以被破坏,其中的二价铁被氧化后,会促进尖晶石结构分解,有利于其参与化学反应。(1)、铬铁矿中的基态二价铁被氧化过程中,失去的电子所处的能级为。(2)、120℃时,向铬铁矿矿粉中加入50%的H2SO4 , 不断搅拌,铬铁矿溶解速率很慢。向溶液中加入一定量的CrO3 , 矿粉溶解速率明显加快,得到含较多Cr3+和Fe3+的溶液。写出加入CrO3后促进尖晶石溶解的离子方程式:。(3)、其它条件不变,测得不同温度下Cr3+的浸出率随酸浸时间的变化如图1所示。实际酸浸过程中选择120℃的原因是。
 (4)、已知:室温下Ksp[Cr(OH)3]=8×10-31 , Ksp[Fe(OH)3]=3×10-39 , 可通过调节溶液的pH,除去酸浸后混合液中的Fe3+。实验测得除铁率和铬损失率随混合液pH的变化如图2所示。pH=3时铬损失率高达38%的原因是。
(4)、已知:室温下Ksp[Cr(OH)3]=8×10-31 , Ksp[Fe(OH)3]=3×10-39 , 可通过调节溶液的pH,除去酸浸后混合液中的Fe3+。实验测得除铁率和铬损失率随混合液pH的变化如图2所示。pH=3时铬损失率高达38%的原因是。 (5)、在酸浸后的混合液中加入有机萃取剂,萃取后,Fe2(SO4)3进入有机层,Cr2(SO4)3进入水层。取10.00mL水层溶液于锥形瓶中,先加入氢氧化钠调节溶液至碱性,再加入足量过氧化氢溶液。充分反应后,加热煮沸除去过量过氧化氢。待溶液冷却至室温,加入硫酸和磷酸的混合酸酸化,此时溶液中Cr全部为+6价。在酸化后的溶液中加入足量KI溶液,以淀粉溶液作指示剂,用0.3000mol·L-1Na2S2O3溶液滴定,发生反应:I2+2S2O =S4O +2I- , 滴定至终点时消耗Na2S2O3溶液19.80mL,计算萃取所得水层溶液中Cr3+的物质的量浓度。(写出计算过程)15. 化合物H具有抗菌、消炎、降血压等多种功效,其合成路线如图:
(5)、在酸浸后的混合液中加入有机萃取剂,萃取后,Fe2(SO4)3进入有机层,Cr2(SO4)3进入水层。取10.00mL水层溶液于锥形瓶中,先加入氢氧化钠调节溶液至碱性,再加入足量过氧化氢溶液。充分反应后,加热煮沸除去过量过氧化氢。待溶液冷却至室温,加入硫酸和磷酸的混合酸酸化,此时溶液中Cr全部为+6价。在酸化后的溶液中加入足量KI溶液,以淀粉溶液作指示剂,用0.3000mol·L-1Na2S2O3溶液滴定,发生反应:I2+2S2O =S4O +2I- , 滴定至终点时消耗Na2S2O3溶液19.80mL,计算萃取所得水层溶液中Cr3+的物质的量浓度。(写出计算过程)15. 化合物H具有抗菌、消炎、降血压等多种功效,其合成路线如图: (1)、A→B的反应类型为。(2)、可用于鉴别B与C的常用化学试剂为。(3)、F分子中碳原子的轨道杂化类型有种。(4)、D的分子式为C10H11O2Cl,写出D的结构简式:。(5)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、A→B的反应类型为。(2)、可用于鉴别B与C的常用化学试剂为。(3)、F分子中碳原子的轨道杂化类型有种。(4)、D的分子式为C10H11O2Cl,写出D的结构简式:。(5)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中含苯环和碳氮双键,能发生银镜反应;
②分子中有4种不同化学环境的氢原子。
(6)、设计以 、乙烯为原料制备
、乙烯为原料制备  的合成路线(无机试剂和有机溶剂任选,合成路线示例见本题题干)。 16. 三氯化六氨合钴(III){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以活性炭为催化剂,合成三氯化六氨合钴(III)晶体的流程如图
的合成路线(无机试剂和有机溶剂任选,合成路线示例见本题题干)。 16. 三氯化六氨合钴(III){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。实验室以活性炭为催化剂,合成三氯化六氨合钴(III)晶体的流程如图
已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3·6H2O在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
(1)、“混合”时加入的NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是。(2)、在如图所示实验装置的三颈烧瓶中,发生“配合、氧化”。
①控制三颈烧瓶中溶液温度为60℃的原因是。
②“配合”步骤安排在“氧化”步骤之前的目的是。
③向三颈烧瓶中滴加氨水的实验操作为。加入H2O2溶液时发生反应的离子方程式为。
(3)、设计由过滤后的滤渣获取[Co(NH3)6]Cl3·6H2O的实验方案:向滤渣中加入80℃左右的热水, , 低温干燥。(实验中须使用的试剂:浓盐酸、无水乙醇)17. 芯片是国家科技的心脏。在硅及其化合物上进行蚀刻是芯片制造中非常重要的环节。三氟化氮(NF3)、四氟化碳(CF4)是常见的蚀刻剂。(1)、高纯三氟化氮对二氧化硅具有优异的蚀刻速率和选择性。①二氧化硅的晶胞结构如图所示,二氧化硅晶体中硅原子周围最近的硅原子有个。

②工业上常采用F2直接氟化尿素[CO(NH2)2]的方法生产NF3。得到的NF3中常含有少量CF4。常温下,三种物质在水中的溶解性大小顺序为:CF4<NF3<NH3 , 原因是。
(2)、四氟化碳的一种蚀刻机理是:CF4在等离子体的条件下产生活性自由基(▪F),该自由基易与硅及其化合物中的硅原子结合生成SiF4气体从而达到蚀刻目的。用CF4(g)进行蚀刻时常与氧气混合,当混合气体的流速分别为80mL·min-1和100mL·min-1时,蚀刻速率随混合气体中O2和CF4体积之比[V(O2)/V(CF4)]的变化如图所示。
①a点蚀刻速率比b点快的原因是。
②蚀刻速率随V(O2)/V(CF4)先升高后降低的原因是。
(3)、NF3是一种强温室气体,消除大气中的NF3对于环境保护具有重要意义。国内某科研团队研究了利用氢自由基(·H)的脱氟反应实现NF3的降解。降解生成·NF2和HF的两种反应历程如图所示。其中直接抽提反应是降解的主要历程,原因是。