福建省漳州市2021年高考化学二模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关,下列说法错误的是( )A、利用 、 和 的强氧化性进行消毒 B、电热水器用镁棒防止铁质内胆腐蚀,原理是牺牲阳极的阴极保护法 C、某品牌运动服材料的主要成分聚氨酯,属于有机高分子化合物 D、实施“煤改气”等清洁燃料改造工程,有利于保护环境2. 左旋多巴(
 )用于改善肌强直和运动迟缓效果明显,下列有关该物质的说法错误的是( ) A、其分子式为 B、能与酸或碱反应生成盐 C、核磁共振氢谱上共有9个峰 D、分子中最多有6个碳原子共平面3. 设 为阿伏加德罗常数的值,下列叙述正确的是( )A、 溶液中含有 数目为 B、含 的浓盐酸与足量 反应,转移电子数目为 C、标准状况下, 己烷在 中完全燃烧,产生 分子数目为 D、常温下, 与 的混合气体中所含的原子数目为4. 下列实验方案正确的是( )
)用于改善肌强直和运动迟缓效果明显,下列有关该物质的说法错误的是( ) A、其分子式为 B、能与酸或碱反应生成盐 C、核磁共振氢谱上共有9个峰 D、分子中最多有6个碳原子共平面3. 设 为阿伏加德罗常数的值,下列叙述正确的是( )A、 溶液中含有 数目为 B、含 的浓盐酸与足量 反应,转移电子数目为 C、标准状况下, 己烷在 中完全燃烧,产生 分子数目为 D、常温下, 与 的混合气体中所含的原子数目为4. 下列实验方案正确的是( )A
B
C
D




分离四氯化碳与水
除去食盐水中的泥沙
制备乙酸乙酯
分离苯和硝基苯
A、A B、B C、C D、D5. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的一种核素没有中子,X是地壳中含量最高的元素,Y的最高价氧化物的水化物是两性氢氧化物,Z的最高化合价与最低化合价代数和为4,下列说法错误的是( )A、原子半径:Z>Y>X B、最外层电子数:Z>Y>W C、X和Y的简单离子具有相同的电子层结构 D、Z的最高价氧化物的水化物是强酸6. 锰系氧化物催化降解甲醛具有去除效率高无二次污染等优点,其中一种催化机理如图所示。下列说法错误的是( ) A、 为中间产物 B、 降低了反应①的活化能 C、反应②中有碳氧键断裂 D、该机理的总反应的化学方程式为7. 下列实验操作能达到相应目的的是( )
A、 为中间产物 B、 降低了反应①的活化能 C、反应②中有碳氧键断裂 D、该机理的总反应的化学方程式为7. 下列实验操作能达到相应目的的是( )选项
实验目的
实验操作
A
除去 气体中混有的
将混合气体通过饱和 溶液
B
配制 溶液
将 溶解在水中,配制成 溶液
C
比较 和 酸性强弱
同温下,用 试纸测定 溶液和 溶液的
D
除去 固体中的少量 杂质
将固体溶于水配成溶液,蒸发浓缩、冷却结晶
A、A B、B C、C D、D8. 下列离子方程式书写正确的是( )A、用醋酸除去水垢:CaCO3+2H+=Ca2++CO2 +H2O B、过量浓硝酸中加入铜片:3Cu +8H++2 =3Cu2++2NO↑+4H2O C、氢氧化钡溶液和稀硫酸恰好中和:Ba2++OH-+H++ =BaSO4 +H2O D、碳酸氢钠溶液中加入过量的澄清石灰水: +OH-+Ca2+= CaCO3 +H2O9. 《Science》杂志报道了王浩天教授团队发明制取 的绿色方法,原理如图所示。已知: , 。下列说法错误的是( ) A、该过程中主要的能量转化形式为化学能转化为电能 B、Y膜为选择性阴离子交换膜 C、每生成 ,理论上需消耗标准状况下 D、b极上的电极反应式为10. 常温下,将 溶液分别滴加到等体积、等浓度的HA、HB两种弱酸溶液中,两溶液的pH与粒子浓度比值的对数关系如图所示。下列说法错误的是( )
A、该过程中主要的能量转化形式为化学能转化为电能 B、Y膜为选择性阴离子交换膜 C、每生成 ,理论上需消耗标准状况下 D、b极上的电极反应式为10. 常温下,将 溶液分别滴加到等体积、等浓度的HA、HB两种弱酸溶液中,两溶液的pH与粒子浓度比值的对数关系如图所示。下列说法错误的是( ) A、 B、加入 溶液的体积:b<a C、常温下,相同浓度的两种溶液的 : D、a点时,
A、 B、加入 溶液的体积:b<a C、常温下,相同浓度的两种溶液的 : D、a点时,二、非选择题
-
11. 铬铁矿的主要成分为亚铬酸亚铁( ),还含有 及少量难溶于水和碱溶液的杂质。以铬铁矿为原料制备重铬酸钾( )的工艺流程如图所示:

回答下列问题:
(1)、为了加快“煅烧”的反应速率,可以采取的措施有(写一条即可)。(2)、亚铬酸亚铁( )中铬元素的化合价为;“煅烧”后亚铬酸亚铁转化为 和 ,该反应的氧化剂和还原剂的物质的量之比为。(3)、“水浸”时, 遇水强烈水解,有红褐色沉淀产生,其水解的离子方程式为。(4)、“滤液1”中主要含有 、 、 等阴离子。利用“煅烧”产生的气体X调节pH,可防止产品混入较多的杂质,则气体X为(填化学式,下同),滤渣2的主要成分为。(5)、“铬转化”时,若盐酸浓度过大,在较高温度下 会转化为 ,影响产品的纯度并产生有毒气体污染环境,写出影响产品纯度的相关反应离子方程式。(6)、处理含有 的酸性废水防止铬对环境产生污染。①每次取废水样品amL,用 溶液进行处理,将 转化为毒性较低的 ,同时 转化为 ,平均每次消耗了vmL。废水中 为。(用含a、b、v的式子表示)。
②室温下,将上述溶液再调节至 ,使 转化成 而沉降,分离出污泥,检测到废水中 浓度约为 ,室温下 。
12. 为探究 能否氧化 ,某兴趣小组用 溶液( )和 溶液( )进行如下操作并记录现象。已知:① (紫色)
② 遇 无明显现象
③ 能显著减慢 的紫色褪去
实验编号
I
II
实验操作


实验现象
溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊
溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊
(1)、配制 溶液时,需要用盐酸酸化,原因是(用化学方程式表示)。(2)、分析实验I:若向紫色溶液中加入酸,会使体系I中(填离子符号)浓度增大,导致 平衡正向移动,溶液紫色变深;出现淡黄色浑浊是因为 与 发生了反应,该反应的离子方程式为。(3)、分析实验II:溶液紫色褪去,是因为 被(填“氧化”或“还原”)成 ,该反应的离子方程式为。(4)、实验I中出现淡黄色浑浊,而实验II中未出现淡黄色浑浊的原因是。(5)、请设计实验方案证明 反应是有限度的。13. 科学家利用Li4SiO4吸附CO2 , 对于实现废气资源的再利用及碳循环经济技术的发展都具有重要意义。回答下列问题:(1)、可用Li2CO3与SiO2反应制取吸附剂Li4SiO4。已知:2Li2O(s)+SiO2(s)=Li4SiO4(s) ΔH1=akJ⋅mol-1
Li2CO3(s)+SiO2(s)=Li2SiO3(s)+CO2(g) ΔH2=bkJ⋅mol-1
Li2SiO3(s)=Li2O(s)+SiO2(s) ΔH3=ckJ⋅mol-1
则2Li2CO3(s)+SiO2(s)=Li4SiO4(s)+2CO2(g) ΔH=kJ⋅mol−1(用含a、b、c的式子表示)。
(2)、CO2的吸附回收及材料再生的原理如下图所示: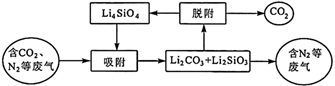
“吸附”过程中主要反应的化学方程式为。
(3)、为了探究Li4SiO4的吸附效果,在刚性容器中放入1000g的Li4SiO4吸附剂,通入10.0mol不同比例的N2和CO2混合气体,控制反应时间均为2小时,得到Li4SiO4吸附CO2后固体样品质量百分数与温度的关系如下图所示。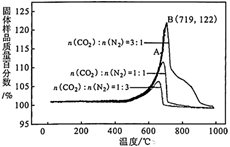
①该反应为反应(填“吸热”或“放热”)。
②A点的v正v逆(填“>”、“<”或“=”),理由是。
③不同CO2的体积分数对于吸附速率的影响是。
④保持B点的温度不变,若所用刚性容器体积为原来的一半,则平衡时理论上c(CO2)较原平衡(填“增大”、“减小”或“不变”)。
⑤B点CO2的吸收率为(保留3位有效数字)。
14. 卟啉化合物在生命科学、太阳能储存等众多领域具有广阔的应用前景。回答下列问题:I.四苯基金属锌卟啉配合物具有促进细胞组织呼吸、改善蛋白质和糖代谢等作用,其合成过程如下(ph-为苯基):
 (1)、配合物中基态Zn原子的价电子排布式为 , C原子的杂化类型为。(2)、合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为。(3)、乙醇的沸点高于二氯甲烷的沸点,主要原因是。(4)、II.研究表明利用卟啉配合物对钙钛矿薄膜进行修饰调控,可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。
(1)、配合物中基态Zn原子的价电子排布式为 , C原子的杂化类型为。(2)、合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为。(3)、乙醇的沸点高于二氯甲烷的沸点,主要原因是。(4)、II.研究表明利用卟啉配合物对钙钛矿薄膜进行修饰调控,可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。
钙钛矿晶胞如图所示,Ti4+处于6个O2-组成的空隙中,若Ca2+与O2-的最短距离为anm,设NA为阿伏加德罗常数的值,则晶体的密度为g∙cm-3(列出计算表达式)。
(5)、在钙钛矿晶胞结构的另一种表示中,Ti4+处于各顶点位置,则O2-处于位置。15. 沙芬酰胺是治疗帕金森病的新药,一种合成路线如下:
回答下列问题:
(1)、A的化学名称为 , B中含有的官能团名称为。(2)、写出③的反应方程式。(3)、⑤的中间产物极不稳定,易失去一分子水最终生成F,F的结构简式为。(4)、⑥的反应类型为。(5)、 是沙芬酰胺另一种合成路线的原料,有机物G与该原料的分子式相差1个CH2原子团。G有多种同分异构体,写出一种同时满足下列条件的同分异构体的结构简式。
是沙芬酰胺另一种合成路线的原料,有机物G与该原料的分子式相差1个CH2原子团。G有多种同分异构体,写出一种同时满足下列条件的同分异构体的结构简式。 ①苯环上有两个对位取代基
②能与FeCl3溶液发生显色反应