福建省厦门市2021年高考化学三模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 我国古代《演繁露》记载:“盐已成卤水,暴烈日,即成方印,洁白可爱,初小渐大或数十印累累相连”,其中涉及的分离方法是( )A、升华 B、蒸发 C、萃取 D、过滤
-
2. 科学家设计下列装置捕获 ,助力碳中和。下列有关说法错误的是( )
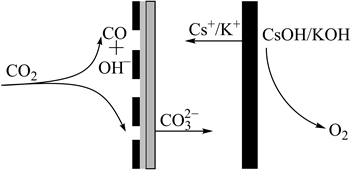 A、 与 中心原子的杂化方式相同 B、 的电子式为 C、阳极电极反应式为 D、 的结构式为
A、 与 中心原子的杂化方式相同 B、 的电子式为 C、阳极电极反应式为 D、 的结构式为 -
3. 利用西红柿中提取的烟酸为原料可合成降血脂药物灭脂灵,其结构式如图所示。下列有关该化合物的叙述正确的是( )
 A、碳原子的杂化方式有3种 B、1mol灭脂灵发生水解可生成3mol
A、碳原子的杂化方式有3种 B、1mol灭脂灵发生水解可生成3mol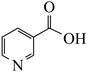 C、含有1个手性碳原子
D、一氯代物有16种(不考虑立体异构)
C、含有1个手性碳原子
D、一氯代物有16种(不考虑立体异构)
-
4. 侯氏制碱法涉及的主要反应为 。 为阿伏加德罗常数的值,下列有关说法错误的是( )A、标准状况下,5.6L 的分子数为0.25 B、1个 晶胞的质量为 C、1L0.1 溶液中NH 数目小于0.1 D、反应消耗0.1 析出 数目为0.1
-
5. 生活中处处有化学,下列指定反应的离子方程式错误的是( )A、用 治疗胃酸过多: B、洁厕灵与84消毒液混合后产生氯气: C、用纯碱除硫酸钙水垢: D、用足量银氨溶液检测甲醛:
-
6. 下列实验方案设计正确的是( )



 A、图甲:除NaCl溶液中 、 、 杂质 B、图乙:验证苯和溴发生取代反应 C、图丙:制取并检验乙烯 D、图丁:制取并收集氨气
A、图甲:除NaCl溶液中 、 、 杂质 B、图乙:验证苯和溴发生取代反应 C、图丙:制取并检验乙烯 D、图丁:制取并收集氨气 -
7. 短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是前三种元素组成的二元化合物,0.01mol·L-1q溶液的pH为1.86,上述物质的转化关系如图所示。下列说法错误的是( )
 A、简单离子半径:Y>Z B、最简单氢化物稳定性:X>Y C、键角:p>n D、沸点:m>r
A、简单离子半径:Y>Z B、最简单氢化物稳定性:X>Y C、键角:p>n D、沸点:m>r -
8. CrOx催化丙烷脱氢的反应路径如图所示,图中括号内的数值表示相对能量、箭头上的数值表示能垒,单位为eV。下列相关说法错误的是( )
 A、催化剂活化丙烷分子中甲基上的C-H键 B、“M2→M3”过程仅形成极性共价键 C、该催化循环中Cr的成键数目发生变化 D、该催化循环中丙烷上氢原子转移是决速步
A、催化剂活化丙烷分子中甲基上的C-H键 B、“M2→M3”过程仅形成极性共价键 C、该催化循环中Cr的成键数目发生变化 D、该催化循环中丙烷上氢原子转移是决速步 -
9. 我国研制的碱性锌铁液流电池工作原理如图。下列说法错误的是( )
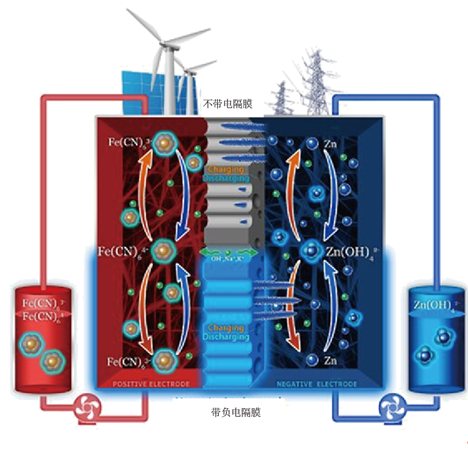 A、充电时,a电极反应式为 B、充电时,b电极区pH增大 C、理论上,每消耗6.5gZn,溶液中将增加0.1 D、采用带负电隔膜可减少充电时产生锌枝晶破坏隔膜
A、充电时,a电极反应式为 B、充电时,b电极区pH增大 C、理论上,每消耗6.5gZn,溶液中将增加0.1 D、采用带负电隔膜可减少充电时产生锌枝晶破坏隔膜 -
10. 谷氨酸(
 )的解离反应式:
)的解离反应式: 

向10.00 0.1000 谷氨酸溶液中通入 或加入 固体,所得溶液 随加入酸或碱的物质的量变化曲线如图。下列说法错误的是( )
A、 B、水的电离程度:b点 点 C、d点存在关系: D、当谷氨酸所带净电荷为0(即 与 数目相等)时,溶液 为3.22
二、非选择题
-
11. 利用废铅蓄电池的铅泥(含PbSO4、PbO2和Pb)制备碱式碳酸铅[2PbCO3·Pb(OH)2]的工艺流程如下图所示:

已知:25℃时, , ,
(1)、“还原”时PbO2转化为PbO,则氧化剂与还原剂的物质的量之比为。(2)、“转化”时溶液中 。(3)、“酸溶”时生成气体的化学方程式有。(4)、“调pH”获得2PbCO3·Pb(OH)2的相关反应:ⅰ.
ⅱ.
产物产率与反应温度、反应后溶液pH关系如下表。
反应温度/℃
反应终液pH值
2PbCO3·Pb(OH)2产率/%
70
4.35
0
85
4.67
47.8
95
5.90
83.4
105
5.36
86.6
①85℃时,产物中PbCO3含量高于2PbCO3·Pb(OH)2是因为尿素水解速率(填“大于”或“小于”) CO 结合Pb2+速率。
②85~95℃,升高温度,2PbCO3·Pb(OH)2产率增加的原因为。
(5)、称取9.085g粗产品,加热分解,测得产生1.100gCO2和0.180gH2O,则产品纯度为(假设杂质只有PbCO3 , 计算结果保留3位有效数字)。 -
12. 碘水中存在可逆反应:I2(aq)+I-(aq) I (aq),为测定该反应的平衡常数K进行如下实验。
实验i 测定平衡体系中I2和I 总浓度

实验ii 测定饱和碘水中I2浓度

已知: 。
(1)、碘量瓶是带磨口塞和水封槽的锥形瓶,盖上塞子后可以水封瓶口,常用于碘量分析本实验采用碘量瓶的目的是。(2)、滴定过程应使用滴定管。(3)、滴定过程,当溶液变为浅黄色时再加入淀粉溶液,滴定终点现象为。(4)、实验i和实验ii中I2浓度近似相等,则实验i剩余碘固体的质量实验ii(填“大于”、“小于”或“等于”)。(5)、实验测得平衡体系中c(I )=mol·L-1 , 平衡常数K=(列表达式即可)(6)、下列关于实验分析的说法正确的是___________(填标号)。A、实验i的碘量瓶在使用前未烘干会影响实验结果 B、实验i应精准控制加入 溶液的体积 C、实验ii吸取上层清液时,不慎吸入碘固体,则测得的K偏大 D、实验ii滴定终点时俯视读数,则测得的K偏大(7)、另外设计实验方案测定平衡常数K:取10.00 碘量瓶②中上层清液,加入10 萃取 并分液。用0.0050 溶液分别滴定水层和有机层、消耗 溶液的体积为 和 。试分析该方案是否可行,并说明理由。 -
13. 低碳烷烃脱氢制低碳烯烃对有效利用化石能源有重要意义。(1)、乙烷脱氢制乙烯
主反应:C2H6(g)=C2H4(g)+H2(g) ΔH1
副反应:2C2H6(g)=C2H4(g)+2CH4(g) ΔH2
C2H6(g)=C(s)+3H2(g) ΔH3
①标准摩尔生成焓是指在25℃和101kPa,由最稳定的单质生成1mol化合物的焓变。利用下表数据计算ΔH1=。
物质
C2H6(g)
C2H4(g)
CH4(g)
标准摩尔生成焓/kJ·mol-1
-84.7
+52.3
-74.8
②恒容条件下,有利于提高C2H6平衡转化率的措施是(填标号)。
A.高温 B.高压 C.原料气中掺入H2 D.原料气中掺入CO2
③在800℃、恒容条件下,1mol C2H6进行脱氢反应,测得平衡体系中气体有0.3mol C2H6、0.6mol C2H4、0.1mol CH4和xmolH2 , 压强为170kPa,则x= , 主反应Kp= kPa。
(2)、乙烷裂解中各基元反应及对应活化能如下表。反应类型
反应
活化能
链引发
ⅰ
451
ⅱ
417
链传递
ⅲ
47
ⅳ
54
ⅴ
181
链终止
ⅵ
0
ⅶ
0
根据上表判断:
①链引发过程中,更容易断裂的化学键是。
②链传递的主要途径为反应→反应(填序号),造成产物甲烷含量不高。
(3)、使用 进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。
①550~620℃,在反应初始阶段,温度越高,乙烷转化率越大的原因是。
②该催化剂的最佳工作温度为。
-
14. 我国科学家合成无铅钙钛矿单晶CsMnCl3(H2O)2 , 在防伪或信息加密等方面具有潜在应用。CsMnCl3(H2O)2溶剂致变色效应原理如下图。
 (1)、基态Mn2+的价电子轨道表达式为。(2)、CsMnCl3(H2O)2中,主族元素的电负性从大到小的顺序为。(3)、变色过程,锰离子的配位数(填“有”或“没有”)发生变化。(4)、从结构角度分析DMAC[结构简式为(CH3)2NCOCH3]能使含锰配离子发生变化的原因。(5)、Cs3MnCl5晶体为正交晶系结构,晶胞参数a=b≠c,α=β=γ=90°,晶胞结构如图所示,其中Mn位于面上。
(1)、基态Mn2+的价电子轨道表达式为。(2)、CsMnCl3(H2O)2中,主族元素的电负性从大到小的顺序为。(3)、变色过程,锰离子的配位数(填“有”或“没有”)发生变化。(4)、从结构角度分析DMAC[结构简式为(CH3)2NCOCH3]能使含锰配离子发生变化的原因。(5)、Cs3MnCl5晶体为正交晶系结构,晶胞参数a=b≠c,α=β=γ=90°,晶胞结构如图所示,其中Mn位于面上。
①每个晶胞含Cs3MnCl5的单元数有个。
②Cs沿z轴投影图正确的是(填标号)。
A.
 B.
B.  C.
C.  D.
D. 
-
15. 大黄酚是常用中药大黄、何首乌的有效成分,其合成路线如下。

已知:

回答下列问题:
(1)、A的化学名称为。(2)、由C生成D的化学方程式为。(3)、E的结构简式为。(4)、由F生成G的反应类型为。(5)、下列对大黄酚的描述,正确的是___________(填标号)。A、分子式为C15H10O4 B、极易溶于水 C、所有碳原子共平面 D、与足量H2加成最多消耗6molH2(6)、M为H的一种同分异构体,已知:1molM与饱和NaHCO3溶液充分反应能生成2molCO2与足量的Na充分反应能生成1.5 molH2;M的核磁共振氢谱显示有五组峰,峰面积之比为4∶4∶2∶1∶1.M的结构简式为。
