福建省泉州市2021年高考化学5月模拟试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 三星堆遗址最近出土了青铜神树、黄金权杖、玉器等文物,下列有关说法错误的是( )A、青铜神树体现了中国古代高超的冶金技术 B、青铜表面的绿色物质主要为Cu2(OH)2CO3 C、青铜神树、黄金权杖、玉器均为合金材料 D、玉器因含有不同金属氧化物而显现不同颜色2. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,2.24 L C3H8分子中的σ键的数目为1.1NA B、5.6 g Fe在7.1 g Cl2中充分燃烧,转移电子数为0.2NA C、0.1 mol NO与0.1 mol O2混合物中质子数为2.3NA D、室温下,pH=9的CH3COONa溶液中,由水电离的H+数目为10-9NA3. 二氢黄樟油素是一种常见的日化香料,可用香桂油为原料制取,反应如下:下列说法错误的是( )
 A、香桂油能发生聚合反应、还原反应 B、香桂油分子中所有碳原子可能共平面 C、二氢黄樟油素的一氯代物有6种 D、可用溴水鉴别以上两种有机物4. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、 的溶液中:Na+、K+、 、 B、c(Fe2+)=0.5mol·L-1的溶液中:H+、Mg2+、 、ClO- C、无色溶液中:Na+、Fe3+、 、 D、能使酚酞变红的溶液中:Al3+、 、Cl-、5. X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素组成的某种化合物可用于防治蛀牙,该化合物的结构如图所示,以下有关说法正确的是( )
A、香桂油能发生聚合反应、还原反应 B、香桂油分子中所有碳原子可能共平面 C、二氢黄樟油素的一氯代物有6种 D、可用溴水鉴别以上两种有机物4. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、 的溶液中:Na+、K+、 、 B、c(Fe2+)=0.5mol·L-1的溶液中:H+、Mg2+、 、ClO- C、无色溶液中:Na+、Fe3+、 、 D、能使酚酞变红的溶液中:Al3+、 、Cl-、5. X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素组成的某种化合物可用于防治蛀牙,该化合物的结构如图所示,以下有关说法正确的是( ) A、简单离子半径:Z>Y>X B、最简单氢化物稳定性:Y>X>W C、Y、Z形成的化合物水溶液呈中性 D、WY5所有原子最外层均为8电子结构6. 以CO2和甲醇(MeOH)为原料合成碳酸二甲酯(
A、简单离子半径:Z>Y>X B、最简单氢化物稳定性:Y>X>W C、Y、Z形成的化合物水溶液呈中性 D、WY5所有原子最外层均为8电子结构6. 以CO2和甲醇(MeOH)为原料合成碳酸二甲酯( )的催化反应机理如图所示。下列说法错误的是( )
)的催化反应机理如图所示。下列说法错误的是( )  A、总反应为:
A、总反应为: B、乙是该反应的中间体
C、甲→乙过程中Sn的配位数未发生改变
D、加入缩醛能使总反应平衡逆向移动
7. 从含砷(As)的有毒工业废水中提取粗As2O3 , 流程如下:
B、乙是该反应的中间体
C、甲→乙过程中Sn的配位数未发生改变
D、加入缩醛能使总反应平衡逆向移动
7. 从含砷(As)的有毒工业废水中提取粗As2O3 , 流程如下:
已知:As与P同为VA族元素;Ca3(AsO3)2微溶于水,Ca3(AsO4)2难溶于水。
下列说法错误的是( )
A、试剂①的作用是将 氧化为 B、滤液①主要成分为NaOH溶液 C、滤液②主要成分可以循环利用 D、“还原”的离子方程式:2H++2 +2SO2=2 +As2O3↓+H2O8. 利用CO2电催化还原法制取清洁燃料HCOOH,可实现温室气体CO2的资源化利用。其工作原理如图。下列有关说法错误的是( )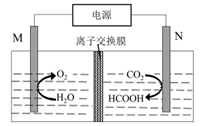 A、M为阳极 B、离子交换膜为阴离子交换膜 C、N极的电极反应式为CO2+2e-+2H+=HCOOH D、消耗的CO2与生成的O2物质的量之比为2:19. 下列装置能达成相应实验目的的是( )
A、M为阳极 B、离子交换膜为阴离子交换膜 C、N极的电极反应式为CO2+2e-+2H+=HCOOH D、消耗的CO2与生成的O2物质的量之比为2:19. 下列装置能达成相应实验目的的是( )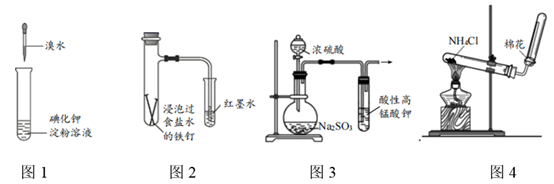 A、图1:比较溴与碘的非金属性强弱 B、图2:探究铁钉的析氢腐蚀 C、图3:验证二氧化硫的漂白性 D、图4:制备并收集氨气10. 25℃时,不同pH环境下H2C2O4不同形态的粒子的分布系数(δ)如图1.用0.200mol·L-1H2C2O4溶液滴定20.00mL0.400mol·L-1NaOH溶液所得滴定曲线如图2.下列说法错误的是( )
A、图1:比较溴与碘的非金属性强弱 B、图2:探究铁钉的析氢腐蚀 C、图3:验证二氧化硫的漂白性 D、图4:制备并收集氨气10. 25℃时,不同pH环境下H2C2O4不同形态的粒子的分布系数(δ)如图1.用0.200mol·L-1H2C2O4溶液滴定20.00mL0.400mol·L-1NaOH溶液所得滴定曲线如图2.下列说法错误的是( ) A、H2C2O4的Ka1=1×10-1.30 B、点n所示溶液中:c( )+2c( )=c(Na+) C、点m到p的溶液中:水的电离程度逐渐减小 D、点p所示溶液中:c(Na+)>c( )>c(H2C2O4)>c( )
A、H2C2O4的Ka1=1×10-1.30 B、点n所示溶液中:c( )+2c( )=c(Na+) C、点m到p的溶液中:水的电离程度逐渐减小 D、点p所示溶液中:c(Na+)>c( )>c(H2C2O4)>c( )二、非选择题
-
11. 工厂处理电镀废水会产生电镀污泥。某镀镍污泥酸浸的滤液含Ni2+、Al3+、Fe2+、Cr3+、Cu2+等离子,可用如下工艺流程回收硫酸镍晶体。

已知:镍的萃取、反萃过程反应为
(1)、检验酸浸滤液中含Fe2+的试剂为。(2)、“电解”过程,阴极的电极反应式为。(3)、滤渣②主要成分为AlPO4、FePO4、CrPO4不同电解电压、电解时间下Fe2+、Cr4+离子的检测结果如下表所示,电解酸浸滤液的最佳电压和时间分别是。电解电压(V)
1.0
1.5
2.0
2.5
3.0
Fe2+
有
有
有
无
无
Cr4+
无
无
无
无
有
电解时间(h)
2.6
3.1
3.6
4.1
4.6
Fe2+
有
无
无
无
无
Cr4+
无
无
有
有
有
(4)、“沉淀”后,溶液中c( )=4.0×10-9mol·L-1 , 则c(Al3+)=。(已知:Ksp(AlPO4)=9.84×10-21)(5)、“反萃”中,加入的X是。(6)、为测定硫酸镍晶体(NiSO4·nH2O)组成,进行如下实验:取5.260g样品,配成250mL溶液,量取25.00mL溶液,用0.100mol·L-1的EDTA(Na2H2Y)标准液滴定(反应为Ni2++H2Y2-=NiY2-+2H+)。重复滴定3次,平均消耗EDTA标准液20.00mL,则硫酸镍的化学式为。12. 瑞尼镍是一种多孔活性金属镍,某兴趣小组用瑞尼镍作催化剂制取氢化肉桂酸:
已知:①金属镍(Ni)常温难以被氧气氧化;
②瑞尼镍孔隙会吸附大量氢气而活化,活化的瑞尼镍接触空气易自燃。
实验步骤如下:
I.制取瑞尼镍:在烧杯中加入浓NaOH溶液,在冰水浴中分批加入铝镍合金(1:1),不断搅拌,充分反应后,分离得到瑞尼镍,保存于无水乙醇中。
II.用如图装置(夹持、搅拌及加热装置省略)制取氢化肉桂酸,步骤如下:

①检查装置气密性,往三颈烧瓶中加入ag肉桂酸、一定量乙醇和I中制得的瑞尼镍。
②通过反复抽气与充气将装置内空气替换成氢气,关闭K3、K2 , 打开K1 , 充入氢气至储氢筒充满氢气,……
③搅拌并加热三颈烧瓶,充分反应后分离出氢化肉桂酸。
回答以下问题:
(1)、铝镍合金与NaOH溶液反应的化学方程式为。(2)、制取瑞尼镍的有关说法错误的是_______。A、该反应为放热反应 B、合金中铝含量过低会减少瑞尼镍的孔隙数量 C、分离得到活性瑞尼镍的方法:过滤 D、检验活性瑞尼镍的方法:取少量样品,用滤纸吸干表面的乙醇,放置于空气中,观察现象(3)、将步骤②的操作补充完整:。(4)、三颈烧瓶加热的方式为。反应过程中,保持长颈漏斗中液面始终高于储氢筒内液面较多的目的:将储氢筒内的氢气压入三颈烧瓶、。判断反应已充分进行的现象为。(5)、若参加反应的氢气体积为bmL(标准状况),则氢化肉桂酸的产率为。(用含a、b的代数式)(6)、从三颈烧瓶中分离出瑞尼镍,得到混合液。从混合液中回收乙醇的操作方法是。13. 氢气选择性催化还原(H2-SCR)是目前消除NO的理想方法,备受研究者关注。H2-SCR法的主反应:
副反应:
回答下列问题:
(1)、已知:①
②提高主反应选择性的最佳措施是。
A.降低温度 B.增大压强 C.增大c(H2) D.使用合适的催化剂
(2)、H2-SCR在Pt-HY催化剂表面的反应机理如下图
①下列有关说法错误的是
A.Pt原子表面上发生反应有N+NO=N2O、N+N=N2等
B.H2解离为H原子,溢流至HY载体上,将吸附于载体的NO2还原
C.从Pt原子表面解吸的NH3 , 在HY载体上转化为
D.HY载体酸性越强,其吸附NO2能力越强,Pt催化活性越大
②已知在HY载体表面发生反应的NO、O2物质的量之比为4:1,补充并配平下列化学方程式: +NO+O2=N2+H2O+。
(3)、T℃, 时,恒容容器中发生上述反应,平衡体系中N2物质的量分数为10%,平衡压强与起始压强之比为3.6:4,则NO的有效去除率(转化为N2)为。(4)、一定条件下,恒温恒容容器中充入c(NO)=2.0×10-3mol·L-1、c(H2)=4.0×10-3mol·L-1 , 只发生反应 ,体系的总压强p随时间t的变化如下表所示:[已知该反应速率方程为υ=k·c(H2)·c2(NO)]t/min
0
10
20
30
40
p/kPa
24
22.6
21.6
21
21
①t=20min时,υ=mol·L-1·s-1(速率常数k=1.0×105mol-2·L2·s-1)
②用平衡分压代替平衡浓度可以得到平衡常数Kp , 则该条件下反应的平衡常数Kp=。
14. 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:(1)、基态S原子的价电子排布图为。(2)、硫氰酸根离子(SCN-)的结构式为。(3)、甲脒(FA)的结构简式为
①其组成元素的电负性由小到大的排序为 , 其中碳原子的杂化方式为。
②甲脒比丙烷的熔点更高的原因是。
(4)、水中铅测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(图1)
①该络合物可溶于四氯化碳,其晶体类型为。
②该络合物分子内不存在的微粒间作用力有。(选填序号)
a.σ键 b.π键 c.非极性键 d.配位健 e.离子键
(5)、FAPbI3的晶体结构单元如图2所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为。15. 新假荆芥内酯(neonepetalactone)可用作杀虫剂,其合成路线如下:
已知:
①


②
(1)、B的含氧官能团名称为(2)、下列有关说法正确的是_______A、A的分子式为C10H16O2 B、C分子中有手性碳原子 C、③的反应条件可为“酸性KMnO4溶液” D、1molD最多与3molH2加成(3)、E的结构简式为(4)、已知新假荆芥内酯分子结构含两个环,⑥的化学方程式为(5)、D的同分异构体中能同时满足以下三个条件的有种(不考虑立体异构)①属于芳香族化合物
②苯环上有两种不同化学环境的氢原子且个数比为1:2
③1mol有机物最多能与2molNaOH溶液反应