福建省南平市2021年高考化学二模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 化学与生活、科技及环境密切相关。下列说法正确的是( )A、抗击新型冠状病毒用到的“84消毒液”的有效成分为 B、“建本雕版印刷技艺”使用的木质雕版主要成分为纤维素 C、嫦娥四号采样器带回的月壤中的 属于氧化物 D、陶瓷工艺品建盏(中国国家地理标志产品)属于新型无机非金属材料2. 已知 是阿伏加德罗常数的值,下列说法正确的是( )A、 中离子总数为 B、 臭氧含有的质子数为 C、一定条件下, 与 反应生成的 分子数为 D、 溶液中 数为3. 有机物 为合成新型药物中间体,其结构简式如图。下列有关 的说法正确的是( )
 A、分子式为 B、分子中至少有11个碳原子在同一平面上 C、 与溴水反应最多消耗 D、既能与金属 反应又能与 溶液反应4. 下列指定反应的离子方程式错误的是( )A、铅蓄电池放电的总反应:Pb+PbO2+4H++2 =2PbSO4↓+2H2O B、足量CO2通入溶有氨的饱和食盐水:CO2+NH3+H2O+Na+=NaHCO3↓+ C、明矾溶液中滴加Ba(OH)2溶液至沉淀质量最大: D、氯气在碱性环境下将I-氧化成 :5. 从干海带中提取 的流程如图,在实验室利用该流程提取 中不涉及的操作是( )
A、分子式为 B、分子中至少有11个碳原子在同一平面上 C、 与溴水反应最多消耗 D、既能与金属 反应又能与 溶液反应4. 下列指定反应的离子方程式错误的是( )A、铅蓄电池放电的总反应:Pb+PbO2+4H++2 =2PbSO4↓+2H2O B、足量CO2通入溶有氨的饱和食盐水:CO2+NH3+H2O+Na+=NaHCO3↓+ C、明矾溶液中滴加Ba(OH)2溶液至沉淀质量最大: D、氯气在碱性环境下将I-氧化成 :5. 从干海带中提取 的流程如图,在实验室利用该流程提取 中不涉及的操作是( ) A、
A、 B、
B、 C、
C、 D、
D、 6. 血红蛋白在血液中输送氧气的机理如图。载氧前,血红蛋白中 与蛋白质链上咪唑环通过配位键相连;载氧后,氧分子通过配位键与 连接,使 滑入卟啉环中。其中 、 、 、 为元素周期表中1~10号元素。下列说法正确的是( )
6. 血红蛋白在血液中输送氧气的机理如图。载氧前,血红蛋白中 与蛋白质链上咪唑环通过配位键相连;载氧后,氧分子通过配位键与 连接,使 滑入卟啉环中。其中 、 、 、 为元素周期表中1~10号元素。下列说法正确的是( ) A、原子半径大小的顺序为 B、 与 形成的最简单分子的空间构型为正四面体 C、元素最简单氢化物稳定性的顺序为 D、由 、W、 三种元素组成的化合物一定为酸7. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( )
A、原子半径大小的顺序为 B、 与 形成的最简单分子的空间构型为正四面体 C、元素最简单氢化物稳定性的顺序为 D、由 、W、 三种元素组成的化合物一定为酸7. 甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( ) A、甲硫醇的沸点比甲醇低 B、该催化剂可有效提高反应物的平衡转化率 C、反应过程中涉及极性键的断裂和生成 D、该反应的化学方程式为8. 燃煤烟气中含有 和 等物质,用如图装置测定 含量。已知异丙醇溶液可选择性吸收 并转化为 ,也可溶解少量 ,实验中应尽快除去 。
A、甲硫醇的沸点比甲醇低 B、该催化剂可有效提高反应物的平衡转化率 C、反应过程中涉及极性键的断裂和生成 D、该反应的化学方程式为8. 燃煤烟气中含有 和 等物质,用如图装置测定 含量。已知异丙醇溶液可选择性吸收 并转化为 ,也可溶解少量 ,实验中应尽快除去 。
下列说法错误的是( )
A、用空气吹出异丙醇溶液中溶解的 B、通过测定 的质量检测 含量 C、该过程中涉及到反应: D、 冰浴可减少异丙醇的挥发9. 利用微生物燃料电池 处理氨氮废水原理如图。下列叙述正确的是( )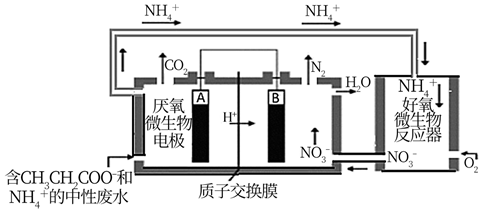 A、微生物燃料电池工作时外电路的电流方向为 B、 极的电极反应式: C、理论上参与反应的 和 的物质的量之比为 D、移去质子交换膜,可提高厌氧微生物电极的性能10. 将 盐酸和 溶液混合后,用 溶液滴定,滴定过程中溶液 随加入 溶液体积变化如图。[ ,忽略溶液混合过程中体积变化]下列说法错误的是( )
A、微生物燃料电池工作时外电路的电流方向为 B、 极的电极反应式: C、理论上参与反应的 和 的物质的量之比为 D、移去质子交换膜,可提高厌氧微生物电极的性能10. 将 盐酸和 溶液混合后,用 溶液滴定,滴定过程中溶液 随加入 溶液体积变化如图。[ ,忽略溶液混合过程中体积变化]下列说法错误的是( ) A、 B、 、 、 三点的溶液中水电离程度依次增大 C、 点溶液中存在: D、 点
A、 B、 、 、 三点的溶液中水电离程度依次增大 C、 点溶液中存在: D、 点二、非选择题
-
11. 华为公司近年开发出石墨烯高能钴酸锂电池,该电池正极铝钴膜主要成分钴酸锂 ,还含有少量的铝、铁、碳等单质。实验室对废旧钴酸锂电池回收利用的流程如图:

已知:①还原性:
② 和 结合生成较稳定的 ,强酸性条件下分解生成
回答下列问题:
(1)、“碱浸泡”时,为提高碱浸泡效率,可采取的措施有(写一条)。(2)、从含铝废液得到固体 的离子方程式为。(3)、滤液 与滤液 中均含有的主要溶质为(填化学式)。 和盐酸反应的化学方程式为。(4)、已知 , ,则反应 的平衡常数为。(5)、将滤液 加入过量盐酸后,再经过、过滤、洗涤、干燥得到 晶体。(6)、为测定产品中草酸钴晶体 的纯度,先称取 样品,将其中草酸钴晶体转化成草酸铵 溶液并用稀硫酸酸化,再用 溶液滴定,达到滴定终点时,共用去 溶液 。滴定时 溶液应盛放在滴定管,草酸钴晶体的纯度为。12. 习近平总书记在科学家座谈会上指出“好奇心是人的天性,对科学兴趣的引导和培养要从娃娃抓起”。某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究 与Cu2+的反应: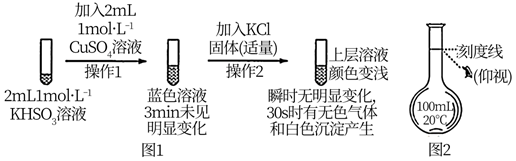
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)、若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为。甲同学在定容时采用上图2方式观察,则所配制的CuSO4溶液浓度(填“偏高”或“偏低”)。(2)、将操作2后生成的无色气体通入氯化铁溶液,(填实验现象),说明该气体为SO2 , 反应的离子方程式为。(3)、操作2后生成的白色沉淀为(填化学式),生成该沉淀和无色气体的反应离子方程式为。(4)、根据氧化还原反应的规律,乙同学推测操作2中涉及 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U型管右管添加 , a电极为极,产生的现象证实了其推测,其中不同于图1操作2后的现象是。
(5)、基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与有关。该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是向U型管左管添加。13. 二氧化碳的综合利用是环保领域研究的热点课题。(1)、Ⅰ. 经过催化氢化合成低碳烯烃。合成乙烯的反应为
已知几种化学键键能如下表所示:
物质
能量
则 (用含字母的代数式表示)。
(2)、反应温度、投料比 对 平衡转化率的影响如图1。① 3(填“>”“<”或“=”,下同); 、 两点反应的平衡常数 。
② 时,往 刚性密闭容器中加入 、 ,反应 达到平衡,则反应开始和平衡时的总压强比为。
(3)、某新型催化剂对 合成低碳烯烃在不同反应温度下的催化性能如图2。
由图2可知,该反应最适宜的温度为 , 理由为。
(4)、Ⅱ. 经过电解转化为化工原料 。图3所示固体氧化物电解池利用具有优良催化活性的电极共电解 。

①阴极生成氢气的电极反应式为。
②电解过程中还伴随着积碳反应 。以下说法正确的是(填标号)。
a.生成的碳覆盖在电极表面,影响电极的催化活性
b.生成的碳使电解效率降低
c.生成的碳会和电解产生的氧气反应
14. 砷化镓 是当前最重要、技术成熟度最高的半导体材料之一、我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。 (1)、基态 原子核外电子排布式为 , 最高能级电子的电子云形状为。(2)、 和 为结构相似的原子晶体,沸点 (填“>”或“<”,下同),第一电离能 。(3)、成语“信口雌黄”中雌黄的分子式为 ,分子结构如图1, 原子的杂化方式为。(4)、 的晶胞结构如图2,在 晶体中,与 原子最近且等距离的 原子数为 , 原子位于 形成的空隙中。(5)、若砷化镓晶胞边长为 ,则 与最近 的核间距为 。15. 香草醇酯能促进能量消耗及代谢,抑制体内脂肪累积,且具有抗氧化、抗炎和抗肿瘤等特性。一种香草醇酯的合成路线如下:
(1)、基态 原子核外电子排布式为 , 最高能级电子的电子云形状为。(2)、 和 为结构相似的原子晶体,沸点 (填“>”或“<”,下同),第一电离能 。(3)、成语“信口雌黄”中雌黄的分子式为 ,分子结构如图1, 原子的杂化方式为。(4)、 的晶胞结构如图2,在 晶体中,与 原子最近且等距离的 原子数为 , 原子位于 形成的空隙中。(5)、若砷化镓晶胞边长为 ,则 与最近 的核间距为 。15. 香草醇酯能促进能量消耗及代谢,抑制体内脂肪累积,且具有抗氧化、抗炎和抗肿瘤等特性。一种香草醇酯的合成路线如下:
已知:

回答下列有关问题:
(1)、 的名称为(用系统命名法命名), 中含氧官能团的名称为。(2)、 生成 的化学方程式为。(3)、 与 反应生成 的反应类型为。(4)、 与 溶液反应时最多消耗 的物质的量为。(5)、苯环上有两个取代基且能使 溶液变紫色的 的同分异构体有种,其中不含甲基的同分异构体的结构简式为(写出一种即可)。