福建省龙岩市2021年高考化学三模试卷
试卷更新日期:2021-06-22 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关,下列有关说法正确的是( )A、龙岩传统美食—麻粩的制作过程中用到的糯米、白砂糖、麦芽糖等都属于纯净物 B、客家米酒酿造过程中加入“酒曲”和馒头制作过程中加入“发酵粉”的作用原理相同 C、用酒精擦去衣服上的油脂未涉及化学变化 D、大豆中富含蛋白质,豆浆煮沸后蛋白质就变成了氨基酸2. 七叶内酯(
 )具有抗菌、抗炎、镇静等作用。下列关于七叶内酯的说法错误的是( ) A、分子式为C9H6O4 B、能使溴水和酸性高锰酸钾溶液退色 C、分子内所有原子可能共平面 D、1mol七叶内酯与足量NaOH溶液反应消耗3mol NaOH3. 设NA是阿伏加德罗常数的值,下列说法错误的是( )A、电解精炼铜,当阳极质量减轻32g,电路中转移电子数为NA B、常温常压下,42g乙烯和丁烯的混合物中含3NA个碳原子 C、1.0L0.20mol·L-1FeCl3溶液滴入沸水中,所得Fe(OH)3胶粒数小于0.2NA D、常温下,2.0LpH=9的CH3COONa溶液中,由水电离出的H+数为2.0×10-5NA4. 下列实验设计能达到相应实验目的的是( )
)具有抗菌、抗炎、镇静等作用。下列关于七叶内酯的说法错误的是( ) A、分子式为C9H6O4 B、能使溴水和酸性高锰酸钾溶液退色 C、分子内所有原子可能共平面 D、1mol七叶内酯与足量NaOH溶液反应消耗3mol NaOH3. 设NA是阿伏加德罗常数的值,下列说法错误的是( )A、电解精炼铜,当阳极质量减轻32g,电路中转移电子数为NA B、常温常压下,42g乙烯和丁烯的混合物中含3NA个碳原子 C、1.0L0.20mol·L-1FeCl3溶液滴入沸水中,所得Fe(OH)3胶粒数小于0.2NA D、常温下,2.0LpH=9的CH3COONa溶液中,由水电离出的H+数为2.0×10-5NA4. 下列实验设计能达到相应实验目的的是( )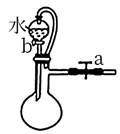
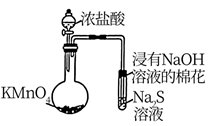
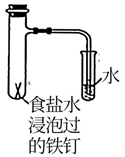
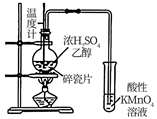
A.关闭a,打开b,可检验装置的气密性
B.比较KMnO4、Cl2、S的氧化性强弱
C.验证铁钉能发生析氢腐蚀
D.检验乙醇消去反应的产物乙烯
A、A B、B C、C D、D5. 铜基催化剂在二氧化碳加氢合成甲醇中起了关键作用、转化过程如图。下列说法错误的是( ) A、总反应化学方程式为 B、步骤②有机物发生了还原反应 C、步骤④有极性键的断裂与形成 D、铜基催化剂的使用可以提高二氧化碳合成甲醇的平衡转化率6. X、Y、Z、W是原子序数依次增大的短周期主族元素,这些元素形成的常见二元化合物或单质存在如图所示的转化关系(部分生成物已省略),其中只有乙为单质。丁是淡黄色固体。焰色反应呈黄色,已为红棕色气体,对下列说法正确的是( )
A、总反应化学方程式为 B、步骤②有机物发生了还原反应 C、步骤④有极性键的断裂与形成 D、铜基催化剂的使用可以提高二氧化碳合成甲醇的平衡转化率6. X、Y、Z、W是原子序数依次增大的短周期主族元素,这些元素形成的常见二元化合物或单质存在如图所示的转化关系(部分生成物已省略),其中只有乙为单质。丁是淡黄色固体。焰色反应呈黄色,已为红棕色气体,对下列说法正确的是( ) A、简单离子半径大小:W>Y>Z>X B、丁中阴阳离子于个数比为1∶1 C、X、Y、Z三种元素可组成离子化合物 D、最简单气态氢化物的热稳定性:T>Z7. 下列有关离子方程式书写错误的是( )A、NaHCO3加入过量的Ba(OH)2溶液: B、用高锰酸钾标准溶液滴定草酸: C、SO2通入BaCl2溶液无现象,再通入Cl2后产生白色沉淀:Cl2+SO2+Ba2++2H2O=BaSO4+2Cl-+4H+ D、用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+8. 某光电催化反应器如图所示,A电极是Pt/CNT、B电极是TiO2:通过光解水,可由CO2制得异丙醇。下列说法错误的是( )
A、简单离子半径大小:W>Y>Z>X B、丁中阴阳离子于个数比为1∶1 C、X、Y、Z三种元素可组成离子化合物 D、最简单气态氢化物的热稳定性:T>Z7. 下列有关离子方程式书写错误的是( )A、NaHCO3加入过量的Ba(OH)2溶液: B、用高锰酸钾标准溶液滴定草酸: C、SO2通入BaCl2溶液无现象,再通入Cl2后产生白色沉淀:Cl2+SO2+Ba2++2H2O=BaSO4+2Cl-+4H+ D、用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+8. 某光电催化反应器如图所示,A电极是Pt/CNT、B电极是TiO2:通过光解水,可由CO2制得异丙醇。下列说法错误的是( ) A、电子由B极经导线流向A极 B、合成蛋白质纤维膜可以是质子交换膜 C、B极的电极反应为2H2O﹣4e﹣=O2 +4H﹣ D、每生成60g异丙醇电路中通过的电子数目为18NA9. 室温下,向20.00mL 0.10mol·L﹣1 HX溶液中逐滴滴加0.10mol·L﹣1 NaOH溶液,溶液pH随 变化关系如图所示,已知 。下列说法错误的是( )
A、电子由B极经导线流向A极 B、合成蛋白质纤维膜可以是质子交换膜 C、B极的电极反应为2H2O﹣4e﹣=O2 +4H﹣ D、每生成60g异丙醇电路中通过的电子数目为18NA9. 室温下,向20.00mL 0.10mol·L﹣1 HX溶液中逐滴滴加0.10mol·L﹣1 NaOH溶液,溶液pH随 变化关系如图所示,已知 。下列说法错误的是( ) A、HX的电离常数 B、当 时,加入NaOH溶液的体积小于10.00mL C、当加入10.00mL NaOH溶液时: D、如图所示各点对应溶液中水的电离程度:a>c10. 乙苯(
A、HX的电离常数 B、当 时,加入NaOH溶液的体积小于10.00mL C、当加入10.00mL NaOH溶液时: D、如图所示各点对应溶液中水的电离程度:a>c10. 乙苯( — )与Cl2在光照条件下发生一氯取代反应,基本历程如下图: ∙
— )与Cl2在光照条件下发生一氯取代反应,基本历程如下图: ∙ 
已知:中间体稳定性:(A)>(B);产物(C)、(D)物质的量之比为14.5∶1。
下列说法错误的是( )
A、反应④⑤⑥的△H均小于0 B、产生等量的(A)和(B)时,反应③需要消耗更多的能量 C、每产生1mol(D),总共消耗氯气7.75mol D、光照条件下,氯原子更容易取代含H较少的碳原子上的H二、非选择题
-
11. 五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备V2O5的一种工艺流程如下:
 已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:溶液pH
<4.0
6.0—8.0
8.0—10.0
钒元素主要存在形式
请回答下列问题:
(1)、含钒废料中的有机物主要在工序中除去。(2)、“焙烧”产物之一是Mg(VO3)2 , 写出它在“酸浸”(溶液pH<2)过程中发生反应的化学方程式。(3)、常温时,若“调pH净化I”工序中最终溶液pH=7,通过计算判断,此时Cu2+是否已经沉淀完全(已知离子浓度<1.0×10﹣5mol·L﹣1认为沉淀完全;Ksp[Cu(OH)2]=4.8×10﹣30)。(4)、“净化Ⅱ”时若加入过量的(NH4)2CO3 , 可能导致的后果为。(5)、“滤渣2”中含有Mg2(OH)2CO3 , 写出生成Mg2(OH)2CO3的离子方程式。(6)、“煅烧”时,除生成V2O5外,还生成了参与大气循环的气体,写出煅烧时的化学方程式。12. 二氯异氰尿酸钠(简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冰水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。
 +2NaClO(浓)
+2NaClO(浓)  +2NaOH+H2O
+2NaOH+H2O实验步骤如下:
(1)、Ⅰ.制备高浓度NaClO溶液从进料口加入10mL 30% NaOH溶液,在10℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10mL 40% NaOH溶液,继续通入Cl2至溶液pH约为8。
用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是(写名称)。



 (2)、“步骤I”测定溶液pH的方法是。(3)、水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为。(4)、通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是(写一种)。(5)、Ⅱ.制备二氯异氰尿酸钠
(2)、“步骤I”测定溶液pH的方法是。(3)、水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为。(4)、通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是(写一种)。(5)、Ⅱ.制备二氯异氰尿酸钠待步骤Ⅰ结束后,从进料口加入氰尿酸,在搅拌状态下继续通入Cl2 , 在10℃左右下反应30min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
为了使晶体充分析出并分离,需要的操作为、洗涤、干燥。
(6)、继续通入Cl2的目的是。(7)、Ⅲ.二氯异氰尿酸钠有效氯含量测定称取0.1000g样品,用100mL蒸馏水于碘量瓶中溶解后,依次加入20mL 0.3mol·L-1醋酸溶液和过量的KI溶液。用0.1000 mol·L-1 Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00mL。
(已知:

 , )
, )滴定终点的现象为。
(8)、样品有效氯=。( )13. 研究和深度开发CO2的综合应用,实现碳循环是解决温室问题的有效途径,对构建生态文明社会具有重要意义。(1)、CO2可实现以下转化:①
②
已知 的正反应的活化能为c kJ·mol-1 , 则逆反应的活化能为kJ·mol-1.(用含a、b、c代数式表示)
(2)、利用工业废气中的CO2可以制取气态甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1mol CO2和3 mol H2 , 在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,测得5 min时CO2的转化率随温度变化如图所示:
①活化能最大的是反应(填“Ⅰ”:“Ⅱ”或“Ⅲ”)。
②T4温度下,反应Ⅲ的在0~5 min内平均反应速率v(H2)=。
③同一物质b点对应的正反应速率v(正)(填“>”、“<”或“=”)c点对应逆反应速率v(逆)。
④若反应Ⅲ在c点的体系总压强为0.80MPa,则c点反应的Kp=(MPa)-2(Kp为以分压表示的平衡常数)。
(3)、载人飞船,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液中电解液,总反应为: ,CO在极产生,阳极的电极反应式为。14. 氮、锂、锌等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。卟啉锌超分子结构如图所示。 (1)、卟啉锌中H、C、O、N四种元素中,第一电离能最大的是(填元素符号)。(2)、卟啉锌超分子中的碳原子采取的杂化方式为 , 图中①②③④处的化学键属于配位键的是(填序号)。(3)、已知离子核外没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子无颜色的是(填离子符号)。(4)、 的键角小于 ,原因是。(5)、氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为;设氮化锂晶体中,同层N-N间距为a pm,层与层间距为b pm,该物质的密度为g/cm3.(用含a、b的式子表示)
(1)、卟啉锌中H、C、O、N四种元素中,第一电离能最大的是(填元素符号)。(2)、卟啉锌超分子中的碳原子采取的杂化方式为 , 图中①②③④处的化学键属于配位键的是(填序号)。(3)、已知离子核外没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子无颜色的是(填离子符号)。(4)、 的键角小于 ,原因是。(5)、氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为;设氮化锂晶体中,同层N-N间距为a pm,层与层间距为b pm,该物质的密度为g/cm3.(用含a、b的式子表示)
 15. 有机物H是合成雌酮激素的中间体,一种由A制备H的工艺流程如下:
15. 有机物H是合成雌酮激素的中间体,一种由A制备H的工艺流程如下:
已知:Ⅰ.


Ⅱ. 。
回答下列问题:
(1)、D中官能团的名称为。(2)、C→D的反应类型为。(3)、写出B→C的化学方程式。(4)、F的同分异构体有多种,请写出一种满足下列条件的结构简式。①核磁共振氢谱有4峰,峰面积之比为9∶2∶2∶1
②苯环上有2个取代基
③能与FeCl3溶液发生显色反应
④能发生水解反应,不能发生银镜反应
(5)、参照上述合成路线,以甲苯为原料。通过下列合成路线可以制备 。
。 
步骤①所需试剂为;Y的结构简式为。