云南省玉溪市江川区二高2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-18 类型:期中考试
一、单选题(共26小题,每小题2.0分,共52分)
-
1. 将甲烷与乙烯的混合气体通入盛有足量溴水的洗气瓶时,溴水的质量增加了7 g,则混合气体中乙烯在标准状况下的体积是( )A、1.12 L B、5.6 L C、6.4 L D、12.8 L2. 诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别指( )。A、纤维素、油脂 B、蛋白质、烃类 C、淀粉、油脂 D、蛋白质、硬化油3. 军事上,常利用焰色反应的原理制作( )A、燃烧弹 B、信号弹 C、照明弹 D、烟幕弹4. 在容积相同的两个密闭容器中分别充满气体O2、O3 , 当这两个容器内温度和压强相等时,下列说法正确的是 ( )A、两种气体的物质的量不相等 B、两种气体的质量相等 C、两种气体所含的原子数目相等 D、两种气体所含的分子数目相等5. 等质量的下列有机物与足量的金属钠反应,产生的气体最多的是( )A、CH3OH B、CH3CH2OH C、
 D、
D、 6. 下列有关物质鉴别的方法描述不正确的是( )A、无需其他试剂即可鉴别:Na2O2与Na2CO3两种粉末 B、用澄清石灰水鉴别:Na2CO3和NaHCO3两种无色溶液 C、用稀盐酸可以鉴别NaHCO3溶液与Na2CO3溶液 D、利用焰色试验鉴别NaCl溶液和KCl溶液7. 光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )A、钛合金 B、二氧化硅 C、晶体硅 D、氧化铝8. 氯元素的原子结构示意图为
6. 下列有关物质鉴别的方法描述不正确的是( )A、无需其他试剂即可鉴别:Na2O2与Na2CO3两种粉末 B、用澄清石灰水鉴别:Na2CO3和NaHCO3两种无色溶液 C、用稀盐酸可以鉴别NaHCO3溶液与Na2CO3溶液 D、利用焰色试验鉴别NaCl溶液和KCl溶液7. 光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )A、钛合金 B、二氧化硅 C、晶体硅 D、氧化铝8. 氯元素的原子结构示意图为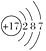 ,下列说法正确的是( ) A、氯原子在化学反应中易失去电子 B、氯原子易得到电子形成稳定的氯离子 C、氯元素的化合价只有-1价 D、氯的原子核外有7个电子9. 下列离子方程式正确的是( )A、铁和硫酸铜溶液的反应:2Fe+Cu2+=2Fe3++Cu B、在硫酸溶液中加入氢氧化钠溶液:H++ OH-=H2O C、硫酸铜溶液与氢氧化钡溶液反应:SO42-+ Ba2+=BaSO4↓ D、向沸水中滴加氯化铁饱和溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+10. 可燃冰又称天然气水合物,它是海底的高压、低温条件下形成的,外观像冰。其化学式为8CH4·46H2O,1体积可燃冰可贮载100~200体积的天然气。下面关于可燃冰的叙述不正确的是( )A、可燃冰有可能成为人类未来的重要能源 B、可燃冰是一种比较洁净的能源 C、可燃冰提供了水可能变成油的例证 D、可燃冰的主要可燃成分是甲烷11. 卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )A、卤素单质的最外层电子数都是7 B、从上到下,卤素原子的电子层数依次增多,半径依次减小 C、从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 D、卤素单质与H2化合由易到难顺序为F2<Cl2<Br2<I212. 原电池产生电流的本质原因是( )A、电解质溶液中有电离出的自由移动的离子 B、有导线将两个活动性不同的电极连接 C、在不同金属的两极间存在电势差 D、在原电池中发生了氧化还原反应13. 已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2 , 发生反应的离子方程式为aFe2++bBr-+cCl2→dFe3++eBr2+fCl- , 下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )A、2、4、3、2、2、6 B、0、2、1、0、1、2 C、2、0、1、2、0、2 D、2、2、2、2、1、414. 3.2 g铜与过量硝酸(8 mol·L-1 , 30 mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol 氢离子,则此时溶液中所含硝酸根离子的物质的量为( )A、(0.2+a) mol B、(0.1+a) mol C、(0.05+a) mol D、amol15. 下列物质可用于干燥氨气的是( )A、浓硫酸 B、碱石灰 C、过氧化钠 D、活性炭16. 关于离子键的下列叙述中不正确的是( )A、离子键是带相反电荷离子之间的一种静电引力 B、离子键的实质是阴离子、阳离子之间的静电作用 C、原子间相互得失电子形成离子键,体系的总能量降低 D、构成离子键的粒子是阳离子和阴离子17. 下列物质中肯定不含有离子键的是( )A、氧化物 B、强酸 C、强碱 D、盐类18. 有下列物质:①小苏打、②硫酸铝、③氯化铁、④磁性氧化铁、⑤氢氧化铁,
,下列说法正确的是( ) A、氯原子在化学反应中易失去电子 B、氯原子易得到电子形成稳定的氯离子 C、氯元素的化合价只有-1价 D、氯的原子核外有7个电子9. 下列离子方程式正确的是( )A、铁和硫酸铜溶液的反应:2Fe+Cu2+=2Fe3++Cu B、在硫酸溶液中加入氢氧化钠溶液:H++ OH-=H2O C、硫酸铜溶液与氢氧化钡溶液反应:SO42-+ Ba2+=BaSO4↓ D、向沸水中滴加氯化铁饱和溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+10. 可燃冰又称天然气水合物,它是海底的高压、低温条件下形成的,外观像冰。其化学式为8CH4·46H2O,1体积可燃冰可贮载100~200体积的天然气。下面关于可燃冰的叙述不正确的是( )A、可燃冰有可能成为人类未来的重要能源 B、可燃冰是一种比较洁净的能源 C、可燃冰提供了水可能变成油的例证 D、可燃冰的主要可燃成分是甲烷11. 卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )A、卤素单质的最外层电子数都是7 B、从上到下,卤素原子的电子层数依次增多,半径依次减小 C、从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 D、卤素单质与H2化合由易到难顺序为F2<Cl2<Br2<I212. 原电池产生电流的本质原因是( )A、电解质溶液中有电离出的自由移动的离子 B、有导线将两个活动性不同的电极连接 C、在不同金属的两极间存在电势差 D、在原电池中发生了氧化还原反应13. 已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2 , 发生反应的离子方程式为aFe2++bBr-+cCl2→dFe3++eBr2+fCl- , 下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )A、2、4、3、2、2、6 B、0、2、1、0、1、2 C、2、0、1、2、0、2 D、2、2、2、2、1、414. 3.2 g铜与过量硝酸(8 mol·L-1 , 30 mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol 氢离子,则此时溶液中所含硝酸根离子的物质的量为( )A、(0.2+a) mol B、(0.1+a) mol C、(0.05+a) mol D、amol15. 下列物质可用于干燥氨气的是( )A、浓硫酸 B、碱石灰 C、过氧化钠 D、活性炭16. 关于离子键的下列叙述中不正确的是( )A、离子键是带相反电荷离子之间的一种静电引力 B、离子键的实质是阴离子、阳离子之间的静电作用 C、原子间相互得失电子形成离子键,体系的总能量降低 D、构成离子键的粒子是阳离子和阴离子17. 下列物质中肯定不含有离子键的是( )A、氧化物 B、强酸 C、强碱 D、盐类18. 有下列物质:①小苏打、②硫酸铝、③氯化铁、④磁性氧化铁、⑤氢氧化铁,其中能通过化合反应制得的是( )
A、①②④⑤ B、①③④⑤ C、②③④⑤ D、①②③④19. 14C常用于测定生物遗骸的年份。下列说法正确的是( )A、14C含有14个中子 B、14C与14N含有相同的质子数 C、14C与C60互为同位素 D、14C与12C是两种不同的核素20. 反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是( )A、v(D)=0.4 mol·L-1·s-1 B、v(C)=0.5 mol·L-1·s-1 C、v(B)=0.6 mol·L-1·s-1 D、v(A)=0.15 mol·L-1·s-121. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景的本质原因是( )A、空气中的小水滴颗粒直径大小约为10-9m~10-7m B、光是一种胶体 C、雾是一种胶体 D、发生丁达尔效应22. 如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为 ( ) A、22.0 L·mol-1 B、22.4 L·mol-1 C、22.8 L·mol-1 D、23.2 L·mol-123. 下列说法正确的是( )A、34S原子核内的中子数为16 B、1H和2H的化学性质相同 C、H O与H O互为同素异形体 D、Na和Na+属于同种元素,且性质相同24. 活性氮原子与二氧化氮反应(N+NO2)同时有四组气体产物:①N2O+O;②2NO;③N2+2O;④N2+O2。测得产物气体平均相对分子质量为28.7,第③组产物所占比例为( )A、13% B、23% C、33% D、43%25. 在二氧化氮被水吸收的反应中,发生还原反应和氧化反应的物质的质量比是( )A、3∶1 B、1∶3 C、1∶2 D、2∶126. 下列关于容量瓶的说法不正确的是( )A、容量瓶上一般标有规格、温度和刻度线 B、容量瓶在使用前要检查是否漏水 C、可将固体或浓溶液直接在容量瓶中溶解或稀释 D、容量瓶不能长时间盛放所配制的溶液,应及时分装在试剂瓶中
A、22.0 L·mol-1 B、22.4 L·mol-1 C、22.8 L·mol-1 D、23.2 L·mol-123. 下列说法正确的是( )A、34S原子核内的中子数为16 B、1H和2H的化学性质相同 C、H O与H O互为同素异形体 D、Na和Na+属于同种元素,且性质相同24. 活性氮原子与二氧化氮反应(N+NO2)同时有四组气体产物:①N2O+O;②2NO;③N2+2O;④N2+O2。测得产物气体平均相对分子质量为28.7,第③组产物所占比例为( )A、13% B、23% C、33% D、43%25. 在二氧化氮被水吸收的反应中,发生还原反应和氧化反应的物质的质量比是( )A、3∶1 B、1∶3 C、1∶2 D、2∶126. 下列关于容量瓶的说法不正确的是( )A、容量瓶上一般标有规格、温度和刻度线 B、容量瓶在使用前要检查是否漏水 C、可将固体或浓溶液直接在容量瓶中溶解或稀释 D、容量瓶不能长时间盛放所配制的溶液,应及时分装在试剂瓶中二、非选择题
-
27. 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸,②Na+水。为点燃上述两个反应生成的H2 , 他们设计了图示装置。请回答下列问题:
 (1)、写出Na与H2O反应的化学方程式:。(2)、实验小组在点燃用上述装置制得的H2时,①实验获得成功,②却失败了。他们分析认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是。(3)、实验小组查阅钠、煤油、水的密度分别为0.97 g·cm-3、0.80 g·cm-3、1.00 g·cm-3 , 并据此对实验进行改进。在改进后的实验中H2的生成速率减慢,原因是。28. 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)、写出Na与H2O反应的化学方程式:。(2)、实验小组在点燃用上述装置制得的H2时,①实验获得成功,②却失败了。他们分析认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是。(3)、实验小组查阅钠、煤油、水的密度分别为0.97 g·cm-3、0.80 g·cm-3、1.00 g·cm-3 , 并据此对实验进行改进。在改进后的实验中H2的生成速率减慢,原因是。28. 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。 (1)、实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:;(2)、实验室用装置E制备Cl2 , 其反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为;(3)、①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是B: , D:;
(1)、实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:;(2)、实验室用装置E制备Cl2 , 其反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为;(3)、①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是B: , D:;②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:。
D:。
29. A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示: (1)、写出B的结构简式;A中官能团的名称为。(2)、验证有机物乙酸中含有-COOH所用的试剂是 , 实验现象是。(3)、写出下列反应的化学方程式:
(1)、写出B的结构简式;A中官能团的名称为。(2)、验证有机物乙酸中含有-COOH所用的试剂是 , 实验现象是。(3)、写出下列反应的化学方程式:反应①;
反应④。
(4)、实验室利用反应③制取C,常用上图乙装置:①a试管中主要反应的化学方程式为。反应类型是。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是。
③试管b中观察到的现象是。
30. A、B、C、D、E 5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3 , C1的质量数分别为C2、C3的 和 ;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。(1)、写出五种微粒的表示符号:A、B、C、D、E。(2)、写出C的同位素名称:C1、C2、C3。(3)、C和D形成的10个电子的分子的化学式为。31. A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如图所示: (1)、A中含有的官能团是;B的结构简式是;D的结构简式是。(2)、反应①的化学方程式是。(3)、反应②的化学方程式是;反应类型是。
(1)、A中含有的官能团是;B的结构简式是;D的结构简式是。(2)、反应①的化学方程式是。(3)、反应②的化学方程式是;反应类型是。