河北省石家庄市2021年高考化学一模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 下列关于新冠病毒传播及防疫的说法错误的是( )A、含有病毒的飞沫分散在空气中形成的分散系为气溶胶 B、医用口罩中无纺布的主要成分为聚丙烯,其原料来源于石油化工产品 C、制作防护服用的主要材料为有机合成高分子材料 D、酒精和84消毒液的消毒原理相同2. 化学与生产生活密切相关。下列说法正确的是( )A、不当开采可燃冰,有可能引发温室效应 B、过期药品和纸箱均需投人到可回收垃圾箱内 C、油脂发生皂化反应后所得产物为高级脂肪酸和甘油 D、燃煤中加入石灰石可以缓解环境污染并提高燃烧效率3. 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为 。下列化学用语的使用正确的是( )A、中子数为16的硫的核素可表示为 B、 的电子式为 C、碳的两种单质金刚石和石墨互为同位素 D、 的比例模型为
 4. 为阿伏加德罗常数的值。下列叙述正确的是( )A、18g 中含有的质子数目为10 B、32g 中含有共价键的数目为5 C、1mol·L-1的硝酸中含有 的数目为 D、标准状况下,11.2L苯中含有碳原子的数目为35. 下列离子方程式正确的是( )A、金属铝溶于稀 溶液: B、 溶于稀盐酸: C、澄清石灰水中加入少量 溶液: D、稀 与 溶液反应:6. 某有机物M为合成青蒿素的中间体,其结构简式如图所示。下列关于M的说法正确的是( )
4. 为阿伏加德罗常数的值。下列叙述正确的是( )A、18g 中含有的质子数目为10 B、32g 中含有共价键的数目为5 C、1mol·L-1的硝酸中含有 的数目为 D、标准状况下,11.2L苯中含有碳原子的数目为35. 下列离子方程式正确的是( )A、金属铝溶于稀 溶液: B、 溶于稀盐酸: C、澄清石灰水中加入少量 溶液: D、稀 与 溶液反应:6. 某有机物M为合成青蒿素的中间体,其结构简式如图所示。下列关于M的说法正确的是( ) A、分子式为 B、分子中含有两种官能团 C、可使酸性高锰酸钾溶液褪色 D、1 M最多能与2 氢气发生加成反应7. 近日,南开大学科研团队以KSn合金为负极,以含羧基多壁碳纳米管( )为正极催化剂构建了可充电K-CO2电池(如图所示),电池反应为 ,其中生成的K2CO3附着在正极上。该成果对改善环境和缓解能源问题具有巨大潜力。下列说法错误的是( )
A、分子式为 B、分子中含有两种官能团 C、可使酸性高锰酸钾溶液褪色 D、1 M最多能与2 氢气发生加成反应7. 近日,南开大学科研团队以KSn合金为负极,以含羧基多壁碳纳米管( )为正极催化剂构建了可充电K-CO2电池(如图所示),电池反应为 ,其中生成的K2CO3附着在正极上。该成果对改善环境和缓解能源问题具有巨大潜力。下列说法错误的是( ) A、 分散在电极表面可促进电子的转移 B、充电时,阳极反应为 C、放电时,内电路中电流由KSn合金经酯基电解质流向 D、为了更好的吸收温室气体CO2 , 可用适当浓度的KOH溶液代替酯基电解质8. 下列实验操作、现象、解释或结论均正确的一组是( )
A、 分散在电极表面可促进电子的转移 B、充电时,阳极反应为 C、放电时,内电路中电流由KSn合金经酯基电解质流向 D、为了更好的吸收温室气体CO2 , 可用适当浓度的KOH溶液代替酯基电解质8. 下列实验操作、现象、解释或结论均正确的一组是( )A
B
C
D
操作

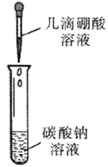


现象
溶液变浑浊
无气泡生成
固体结块,试管底部温度升高
溶液先变红,后褪色
解释或结论
稀盐酸将硫代硫酸钠还原为硫单质
硼酸的酸性弱于碳酸
生成纯碱晶体的反应是放热反应
亚硫酸既有酸性又有漂白性
A、A B、B C、C D、D9. 亚磷酸( )是二元弱酸,主要用于农药中间体以及有机磷水处理药剂原料。已知: 的 ; ,向1L0.5 溶液中滴加等浓度的 溶液。下列说法正确的是( )A、当 时, B、当c =c 时, C、当 时,由水电离出的 D、当 时,10. 利用苯基亚磺亚胺酸酰氯氧化醇制备醛、酮具有反应条件温和的优点,已知 和 均为烷烃基或氢原子,其反应历程如图所示。下列说法正确的是( ) A、反应①为消去反应 B、反应③中存在极性键和非极性键断裂 C、若
A、反应①为消去反应 B、反应③中存在极性键和非极性键断裂 C、若 为 ,则产物可能为碳酸
D、该历程的总反应为
为 ,则产物可能为碳酸
D、该历程的总反应为  11. 短周期元素X、Y、Z、W的原子序数依次增大,其中只有Y为金属元素且Y、W的原子序数之差为3,X、W的原子最外层电子数相同且X形成的简单氢化物的沸点较高。下列说法一定正确的是( )A、简单离子半径: B、单质Z是制作芯片和光电池的关键材料 C、氧化物的熔点: D、W的最高价氧化物的水化物是强酸12. 某小组同学设计实验探究镁与铵盐溶液的反应,记录如下:
11. 短周期元素X、Y、Z、W的原子序数依次增大,其中只有Y为金属元素且Y、W的原子序数之差为3,X、W的原子最外层电子数相同且X形成的简单氢化物的沸点较高。下列说法一定正确的是( )A、简单离子半径: B、单质Z是制作芯片和光电池的关键材料 C、氧化物的熔点: D、W的最高价氧化物的水化物是强酸12. 某小组同学设计实验探究镁与铵盐溶液的反应,记录如下:实验编号
①
②
③
④
溶液种类
1
0.5
0.1
0.48
0.48
0.48
0.48
V(溶液)
100
100
100
100
实验现象
有气体产生,并产生白色沉淀
有气体产生,并产生白色沉淀
有气体产生,并产生白色沉淀
几乎看不到现象
6h时
433
255
347
12
根据上述实验所得结论正确的是( )
A、实验②中发生的反应为 B、由实验①、③可得,溶液中 越大,反应速率越快 C、由实验①、②可得,溶液中阴离子的种类对产生 的速率有影响 D、由实验①~④可得,溶液的 越小,产生 的速率越快13. 25℃时,向不同浓度酸( )中加入 固体,溶解过程中 与溶液 的关系如图所示。下列说法正确的是( ) A、 的 的数量级为 B、温度一定时,c越大, 的溶解度越小 C、温度和 一定时,c越大, 的 越大 D、a点溶液满足:
A、 的 的数量级为 B、温度一定时,c越大, 的溶解度越小 C、温度和 一定时,c越大, 的 越大 D、a点溶液满足:二、多选题
-
14. 工业合成环丁基甲酸的流程如图。下列说法正确的是( )
 A、a和b互为同系物 B、a→b的反应类型为取代反应 C、c分子中所有碳原子均可共面 D、b的一氯代物有4种(不考虑立体异构)15. 钠碱脱硫液( )吸收一定量 气体后,可通过以下装置实现再生。下列说法正确的是( )
A、a和b互为同系物 B、a→b的反应类型为取代反应 C、c分子中所有碳原子均可共面 D、b的一氯代物有4种(不考虑立体异构)15. 钠碱脱硫液( )吸收一定量 气体后,可通过以下装置实现再生。下列说法正确的是( )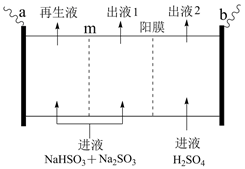 A、电极b应接电源的负极 B、m应为阳离子交换膜 C、出液2的 大于进液 的 D、出液1可使溴水褪色
A、电极b应接电源的负极 B、m应为阳离子交换膜 C、出液2的 大于进液 的 D、出液1可使溴水褪色三、非选择题
-
16. 三草酸合铁(Ⅲ)酸钾 为亮绿色晶体,易溶于水而难溶于乙醇等有机溶剂。某实验小组对三草酸合铁(Ⅲ)酸钾的制备及纯度测定进行探究。
请回答:
(1)、制备三草酸合铁(Ⅲ)酸钾粗品步骤Ⅰ.向 固体中加入饱和 溶液,水浴加热,缓慢滴入足量5% 溶液,并不断搅拌,观察到有红褐色沉淀产生。
步骤Ⅱ.将Ⅰ中所得体系煮沸,并分批加入饱和 溶液,红褐色沉淀溶解,体系变为亮绿色透明溶液。
步骤Ⅲ.向Ⅱ中所得溶液中加入95%乙醇,经结晶、过滤、干燥制得粗品。
①步骤Ⅰ中除产生红褐色沉淀外,还生成 ,则该反应的化学方程式为。
②步骤Ⅱ中“煮沸”的目的为。
③步骤Ⅲ中加入乙醇的作用为。
(2)、测定粗品纯度步骤i.准确称取 粗品,加硫酸酸化后,用 标准液滴定至终点,消耗标准液体积为 。
步骤ii.向步骤Ⅰ滴定后的溶液中加入适当过量的 粉和适量稀 并振荡,加热至沸腾,过滤除去过量 粉;用稀 洗涤锥形瓶和沉淀,将洗涤液与滤液合并,用 标准液滴定至终点,消耗标准液体积为 。
①步骤i中达到滴定终点的现象为。
②产品中 (已知 )的质量分数为;步骤i中达到滴定终点时仰视读取滴定管读数,会使测定结果(填“偏高”“偏低”或“无影响”)。
③步骤ii中,“洗涤锥形瓶和沉淀”的目的为。
(3)、精制粗品欲制得更纯的三草酸合铁(Ⅲ)酸钾产品,(1)中步骤Ⅲ需增加的操作为。
17. 纳米级 复合材料被认为是一种理想的钠离子电池负极材料,以钼精矿[主要成分 ,以及 、 、 、 、 等杂质]为原料生产纳米级 的工业流程如下:
已知:i. 不溶于水和常见的酸碱,“烧熔”时可转化为酸性氧化物 ;
ii. 经“烧熔”后可与沸盐酸反应。
(1)、“粉碎”的目的为。(2)、滤液②中含有的金属离子为;滤渣②的成分为。(3)、“碱浸”时发生反应的化学方程式为;用 溶液代替氨水的不足之处为。(4)、已知“硫代”一步生成了 ,则“沉钼”中加入盐酸生成 的离子方程式为。(5)、用 “加热还原” ,实际操作时需注意的问题为。(6)、分析化学上,常利用“沉钼”反应测定钼的含量,若称量54.0g钼精矿,“沉钼”时得到28.8g ,则钼精矿中钼的百分含量为(转化工艺中钼的损失不计,保留三位有效数字)。18. 丙烯是重要的化工原料,利用丙烷制备丙烯通常有三种方法。(1)、方法一:丙烷直接脱氢法丙烷直接脱氢的主要反应为 。600℃、0.4 下,向装有催化剂的恒压密闭容器中以 投料,发生反应。丙烷的转化率( )随时间(t)变化的曲线如图1所示。

①该体系达到平衡状态的标志为(填选项字母)。
A.单位时间内,消耗 的物质的量等于生成 的物质的量
B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D. 的分压不再改变
②用分压表示该反应的平衡常数 ;增大 的值可提高丙烷的平衡转化率,解释其原因为。
(2)、方法二:丙烷氧化脱氢法丙烷氧化脱氢制丙烯时,主要发生反应 。已知:氢气的燃烧热 为 ;水的气化热 为 ;结合 ,可计算 ;与方法一相比,方法二的优点为(写出一点即可)。
(3)、我国科研机构利用计算机模拟得出:在 表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图2所示),其中 表示过渡态。
由上图分析可知,丙烷氧化脱去的第一个H是与(填“ ”或“ ”)中的O结合,原因为。
(4)、方法三:丙烷与 耦合法丙烷与 耦合法制丙烯时,主要发生如下反应:
i. ii.
iii. iv.
在580℃时,将 和 按体积比为 充入一恒压密闭容器中进行反应,实验测得体系中 、 的转化率和 的选择性、 的产率随催化剂组成和压强的变化分别如图3(a)和(b)所示。

已知: 的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为;随压强增大 的平衡产率先增大后减小的原因为。
19. 钛元素形成的单质及其化合物有重要的应用。请回答:(1)、钛位于元素周期表中区;与钛位于同一周期且含有相同未成对电子数的过渡元素为(填元素符号)。(2)、钛形成的 试剂常用作有机反应的烯化试剂,其结构如图所示。
其中氯原子和铝原子的杂化方式分别为。
(3)、钛形成的 是一种储氢材料。 的立体构型为。(4)、钛形成的不同卤化物熔沸点数据如表所示。熔点/℃
-24.1
38.25
155
沸点/℃
136.45
233.45
377
三种卤化物熔沸点数据呈现表中变化规律的原因为。
(5)、向紫色的 溶液中加入无水乙醚并通入 至饱和,则可得到绿色的 晶体。①晶体中所有元素的电负性由大到小的顺序为。
②晶体中配位原子为;晶体中粒子间存在的作用力有(填选项字母)。
a.离子键 b.σ键 c. 键 d.金属键 e.配位键
(6)、钛酸钡具有压电性,可用于留声机和水下侦察设备等。钛酸钡立方晶胞结构如图所示( 、 都分别与 相互接触),其晶胞参数 。 的配位数为;若 半径为140 ,则 的半径为 。 20. 2-(2-咪唑基)-(4-正丁氧基)苯甲酰苯胺(M)具有潜在的抗肿瘤效应,其一种合成路线如下图所示:
20. 2-(2-咪唑基)-(4-正丁氧基)苯甲酰苯胺(M)具有潜在的抗肿瘤效应,其一种合成路线如下图所示: 已知: (X为 、 或I)。
已知: (X为 、 或I)。请回答:
(1)、已知A的分子式为 ,则A中官能团的名称为;C的结构简式为。(2)、C与H反应生成M的反应类型为。(3)、已知F在转化为G的过程中还生成了乙醇,E为溴代烃,则D和E反应生成F的化学方程式为;E的一种同分异构体,其核磁共振氢谱只有一种氢,其名称为。(4)、符合以下条件的D的同分异构体有种(不考虑立体异构)。①与 溶液显紫色 ②可以发生水解反应 ③苯环上只有2个取代基
(5)、参照上述合成路线和信息,以甲苯为原料(无机试剂任选),设计制备的合成路线。