河北省邯郸市2021年高考化学一模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 人类生活中的方方面面都离不开化学,车辆工程与化学也有着密不可分的关系,下列相关说法中错误的是( )A、汽车上使用的钢化玻璃是掺杂了特种金属的玻璃 B、采用镁、铝及其合金材料可适当减轻车身重量从而提升车辆行驶性能 C、随着乙醇汽油、氢能源、燃料电池等新能源的逐步应用,汽车尾气造成的污染在逐步减少 D、汽车车身采用的镀锌钢板是利用牺牲阳极的阴极保护法来提高车身的抗锈、抗腐蚀能力2. 在水中水解生成 和 。下列化学用语表述错误的是( )A、中子数为9的氧原子: B、 的结构式:
 C、 的结构示意图:
C、 的结构示意图:  D、 的电子式:
D、 的电子式:  3. 有机物M(结构如图)具有杀灭病毒的作用,下列关于M的说法错误的是( )
3. 有机物M(结构如图)具有杀灭病毒的作用,下列关于M的说法错误的是( ) A、所有碳原子不可能共面 B、可使酸性 溶液褪色 C、可与 发生取代反应 D、与苯互为同系物4. 代表阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下, 中含有的中子数为 B、 与足量 反应时,转移的电子总数为 C、 与 充分反应后得到的气体分子数小于 D、常温下, 的 溶液中发生电离的水分子数为5. 下列实验能达到相应目的的是( )
A、所有碳原子不可能共面 B、可使酸性 溶液褪色 C、可与 发生取代反应 D、与苯互为同系物4. 代表阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下, 中含有的中子数为 B、 与足量 反应时,转移的电子总数为 C、 与 充分反应后得到的气体分子数小于 D、常温下, 的 溶液中发生电离的水分子数为5. 下列实验能达到相应目的的是( )



A.在铁上镀铜
B.进行铝热反应
C.蒸干 溶液,制备 固体
D.证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
A、A B、B C、C D、D6. 一定条件下, 可以将 置换出来,其转化的能量变化如下:
则在1538℃时,反应 的 为( )
A、 B、 C、 D、7. 下列对应离子方程式书写正确的是( )A、 溶于稀硝酸: B、将 通入碱性 溶液中: C、将 通入酸性 溶液中: D、向 溶液中加入足量 溶液:8. 时,向一密闭容器中通入 和 ,发生反应为: 。测得不同温度下平衡时体系中各物质浓度c的变化如图,下列叙述错误的是( )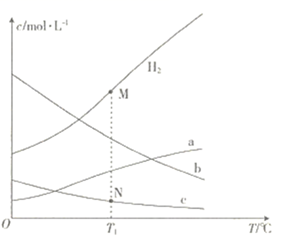 A、该反应的 B、曲线b代表 C、M点和N点所处状态下 不一样 D、保持其他条件不变, 、 下反应达到平衡时, 比M点对应的 小9. 难溶金属氢氧化物 开始沉淀的 (简记pH始)与沉淀完全的 (简记pH终),理论上具有定量关系,假定开始沉淀时 ,设 时沉淀完全,则当 时,pH终-pH始始的值为( )A、1 B、2 C、3 D、410. 科学家利用如图装置将 转化为CO,下列说法正确的是( )
A、该反应的 B、曲线b代表 C、M点和N点所处状态下 不一样 D、保持其他条件不变, 、 下反应达到平衡时, 比M点对应的 小9. 难溶金属氢氧化物 开始沉淀的 (简记pH始)与沉淀完全的 (简记pH终),理论上具有定量关系,假定开始沉淀时 ,设 时沉淀完全,则当 时,pH终-pH始始的值为( )A、1 B、2 C、3 D、410. 科学家利用如图装置将 转化为CO,下列说法正确的是( )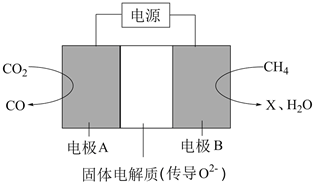 A、电极A接电源的正极,电极B接电源的负极 B、若X为甲酸,在相同条件下消耗 和 的体积比为 C、固体电解质可以换成稀硫酸 D、若X为乙烷,则阳极的反应式为11. X、Y、Z、W、R五种元素形成的化合物结构如图所示,W的单质在常温下为银白色液体,R的单质在常温下为紫黑色固体,Y、Z的单质是空气的主要成分,且X、Y的核外电子数之和与Z的原子序数相等,下列说法错误的是( )
A、电极A接电源的正极,电极B接电源的负极 B、若X为甲酸,在相同条件下消耗 和 的体积比为 C、固体电解质可以换成稀硫酸 D、若X为乙烷,则阳极的反应式为11. X、Y、Z、W、R五种元素形成的化合物结构如图所示,W的单质在常温下为银白色液体,R的单质在常温下为紫黑色固体,Y、Z的单质是空气的主要成分,且X、Y的核外电子数之和与Z的原子序数相等,下列说法错误的是( ) A、原子半径: B、W的单质可用热分解法制备 C、R的单质中混有NaCl时,可用加热的方法提纯 D、X、Y、Z三种元素形成的化合物只能是离子化合物12. 合成药物异搏定路线中的某一步骤如图所示,下列说法正确的是( )
A、原子半径: B、W的单质可用热分解法制备 C、R的单质中混有NaCl时,可用加热的方法提纯 D、X、Y、Z三种元素形成的化合物只能是离子化合物12. 合成药物异搏定路线中的某一步骤如图所示,下列说法正确的是( ) A、X的同分异构体属于酸的只有4种 B、反应 属于加成反应 C、 在Ni的催化下完全氢化,消耗 D、Y有2种官能团且能与NaOH溶液反应13. 利用 分子筛催化剂, 可脱除燃煤烟气中的NO和 ,其反应历程如图所示,下列说法错误的是( )
A、X的同分异构体属于酸的只有4种 B、反应 属于加成反应 C、 在Ni的催化下完全氢化,消耗 D、Y有2种官能团且能与NaOH溶液反应13. 利用 分子筛催化剂, 可脱除燃煤烟气中的NO和 ,其反应历程如图所示,下列说法错误的是( ) A、总反应为 B、X是 ,Y是 C、 是中间产物 D、 属于化合反应14. 高纯碳酸锰在电子工业中被广泛应用,湿法处理软锰矿(主要成分为 ,还含有少量Fe、Si等杂质元素)制备高纯碳酸锰的流程如下:
A、总反应为 B、X是 ,Y是 C、 是中间产物 D、 属于化合反应14. 高纯碳酸锰在电子工业中被广泛应用,湿法处理软锰矿(主要成分为 ,还含有少量Fe、Si等杂质元素)制备高纯碳酸锰的流程如下:
其中除杂过程包括:①室温下,向滤液中加入一定量的试剂X,调节滤液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水( ),过滤。已知:室温下, 。下列说法正确的是( )
A、“浸出”时没有发生氧化还原反应 B、“除杂”试剂X可以是MnO C、室温下,“除杂”时调节滤液的pH为4,此时 D、“沉淀”时加入过量的 溶液,发生反应的离子方程式为15. 25℃时,将 的 溶液加水稀释,混合溶液中 与 的关系如图所示。下列说法正确的是( ) A、 B、P、Q点对应的稀释程度: C、若将溶液无限稀释,溶液中 D、25℃时,加入适量 可使P点移至W点
A、 B、P、Q点对应的稀释程度: C、若将溶液无限稀释,溶液中 D、25℃时,加入适量 可使P点移至W点二、非选择题
-
16. 是制备铁催化剂的主要原料,某化学小组利用莫尔盐 制备 的实验流程如下:
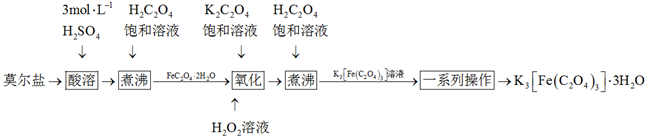
已知:氧化操作中 除生成 外,另一部分铁元素转化为红褐色沉淀。
(1)、“酸溶”时,莫尔盐(填“能”或“不能”)用 的 溶解,原因是。(2)、第一次“煮沸”时,生成 的离子方程式为。(3)、“氧化”时所用的实验装置如图所示(夹持装置略去),导管a的作用是;“氧化”时反应液应保持温度在40℃左右,则适宜的加热方式为(填“直接加热”或“水浴加热”)。 (4)、测定产品中铁的含量。
(4)、测定产品中铁的含量。步骤ⅰ:称量mg样品,加水溶解,加入稀硫酸,再滴入 的 溶液使其恰好反应完全。
步骤ⅱ:向步骤ⅰ所得的溶液中加入过量 粉,反应完全后,滤去不溶物,向溶液中滴入酸化的 的 溶液,滴定至终点,消耗 溶液zmL。
①步骤ⅰ中,若加入的 溶液过量,则所测的铁元素的含量(填“偏大”、“偏小”或“不变”,下同),若步骤ⅱ中不滤去不溶物,则所测的铁元素的含量。
②该样品中铁元素的质量分数为(用含m、y、z的代数式表示)。
17. 碳酸钙是橡胶工业中使用最早且用量最大的填充剂之一、工业上用主要含 及少量 的废渣制取轻质 ,其工艺流程如图:
已知: 时 和 沉淀完全, 时 开始溶解。
回答下列问题:
(1)、“预处理”时的温度不宜太高,原因是 , 为提高“预处理”的反应速率除加热外还可以采取的措施为(写一种即可)。(2)、“滤液1”中的溶质除过量的 外,主要是(填化学式,下同),“滤渣2”的主要成分是。(3)、“调节pH”时,应调节pH至的范围内,物质X可选用(填标号)。A. B. C.
(4)、向“滤渣3”中加入NaOH溶液时,发生反应的离子方程式为。(5)、“沉钙”时所用的物质Y为(填化学式),充分反应后经(填具体操作)后得到轻质 。18. 一定条件下 能氧化 制 ,这对资源综合利用有重要意义。相关的化学反应如下:I.
II.
(1)、已知反应的能量变化如图1所示。
①当生成等物质的量的 时,反应(填“I”或“II”)吸收的热量更多。
② 生成 的热化学方程式为。
(2)、反应II不利于乙烯的生成的原因是。(3)、有研究表明,在催化剂作用下,反应I分两步进行,其反应过程及能量变化如图2所示。①决定反应I的反应速率的步骤是(填“第一步”或“第二步”),原因是。
②第一步的化学方程式为。
(4)、在恒容密闭的容器中充入一定量的 和 ,保持其他条件不变,控制反应温度分别为 和 ,测得 随时间 的变化曲线如图3所示,则 (填“大于”或“小于”) ,原因是。(5)、温度为T时,向一密闭容器中通入 和 ,一段时间后,反应Ⅰ和反应Ⅱ均达到平衡, 的转化率为50%, 的选择性为60%,此时容器容积为 ,则该温度下反应I的平衡常数 。19. 铜及其化合物是生活、生产中运用广泛的材料。(1)、铜元素位于周期表第列,铜易导电的原因是 , 基态 原子中核外能量不同的电子有种。(2)、铜的第二电离能(填“大于”或“小于”)锌的第二电离能,其原因是。(3)、合成氨工业常用醋酸二氨合铜(I) 溶液吸收对氨合成的催化剂有毒害作用的①比较 和 的沸点大小,并说明原因:。
② 中C的杂化类型为。
(4)、晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。 的晶胞结构如图所示,其中原子坐标参数: ; ; 。则D处微粒的坐标参数为。
②晶胞参数:描述晶胞的大小和形状。若 与 的最短距离为 ,则晶胞的边长为 ,设 为阿伏加德罗常数的值,该化合物的密度为(用含a、 的代数式表示)g∙cm-3。
20. H是抗癫痫药物的合成中间体,其合成路线如下:
已知:
 (1)、H中的官能团名称为。(2)、A的名称为。(3)、B、D的结构简式分别为、。(4)、F生成G的反应的化学方程式为 , 反应类型为。(5)、满足下列条件的E的同分异构体有种。
(1)、H中的官能团名称为。(2)、A的名称为。(3)、B、D的结构简式分别为、。(4)、F生成G的反应的化学方程式为 , 反应类型为。(5)、满足下列条件的E的同分异构体有种。①能与 溶液发生显色反应,且能发生银镜反应;
② 该物质完全水解消耗 。
(6)、设计一条以苯甲醇和甲醇为原料制备苯乙烯的合成路线(无机试剂任选)。