河北省邯郸市2021年高考化学二模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 沈括在《梦溪笔谈》中写道:“古以剂钢为刃,柔铁为茎干,不而则多断折。剑之钢者,刃多毁缺”。其中“剂钢”即合金钢,“柔铁”即熟铁,下列说法正确的是( )A、“剂钢”是混合物,“柔铁”是纯净物 B、合金都由两种或两种以上的金属熔合而成 C、改变合金中某种元素的含量可制得不同性能的合金 D、“剂钢”和“柔铁”的强度、硬度和熔点均比纯铁的高2. 下列说法错误的是( )A、煤干馏得到的煤焦油中含有苯酚等芳香烃 B、油脂完全水解的产物中一定含有甘油 C、以秸秆为原料可以得到乙醇等液态燃料 D、乙醛使溴水褪色的原因是乙醛与溴水发生了氧化还原反应3. 下列说法错误的是( )A、沸点: B、HCl的热稳定性比HI差 C、固态NaOH熔化时只破坏离子键,不破坏共价键 D、 中 和 的最-外电子层都形成了8电子稳定结构4. 已知键能:H—H键为 ,Br—Br键为 ,H—Br键为 。一定温度下,反应 的反应历程与能量的关系如图所示。下列叙述正确的是( )
 A、该反应的正反应是放热反应 B、 ,加入催化剂时, 、 及 均减小 C、已知 ,若反应 ,则 D、升高温度,正逆反应速率均加快,且正反应速率加快的程度较大5. 下列说法错误的是( )A、用酸性 溶液可鉴别乙烯和甲烷 B、新制氯水应保存在无色广口瓶中并置于阴冷处 C、强氧化剂与易燃有机物必须隔离存放,以防止火灾发生 D、通过溶液两两混合的方式可鉴别 溶液、 溶液、 溶液、盐酸6. 设 表示阿伏加德罗常数的值,下列叙述正确的是( )A、10g质量分数为46%的乙醇水溶液中所含氧原子数为0.4 B、100mL1mol·L-1的硅酸钠溶液中含有的 数为0.1 C、将2.24L 通入足量溴水中充分反应,生成 的数目为0.4 D、12g 在熔融时的离子总数为0.37. 下列反应的离子方程式书写正确的是( )A、1mol 的溶液与4molNaOH的溶液混合: B、将硫酸酸化的 溶液暴露在空气中: C、苯甲酸与过量 溶液反应:2
A、该反应的正反应是放热反应 B、 ,加入催化剂时, 、 及 均减小 C、已知 ,若反应 ,则 D、升高温度,正逆反应速率均加快,且正反应速率加快的程度较大5. 下列说法错误的是( )A、用酸性 溶液可鉴别乙烯和甲烷 B、新制氯水应保存在无色广口瓶中并置于阴冷处 C、强氧化剂与易燃有机物必须隔离存放,以防止火灾发生 D、通过溶液两两混合的方式可鉴别 溶液、 溶液、 溶液、盐酸6. 设 表示阿伏加德罗常数的值,下列叙述正确的是( )A、10g质量分数为46%的乙醇水溶液中所含氧原子数为0.4 B、100mL1mol·L-1的硅酸钠溶液中含有的 数为0.1 C、将2.24L 通入足量溴水中充分反应,生成 的数目为0.4 D、12g 在熔融时的离子总数为0.37. 下列反应的离子方程式书写正确的是( )A、1mol 的溶液与4molNaOH的溶液混合: B、将硫酸酸化的 溶液暴露在空气中: C、苯甲酸与过量 溶液反应:2 + →2
+ →2  +CO2↑+H2O
D、向 溶液中通入少量 气体:
8. 常温下,溴水与 溶液发生反应: ,若开始时 和 的浓度均为 ,达到平衡时 。假设溶液的体积无变化,下列有关说法错误的是( )A、加入 固体,平衡逆向移动 B、加入 振荡,平衡逆向移动,水层颜色变浅 C、常温下,该反应的平衡常数K的值约为5.1 D、向经苯萃取后的水层溶液中滴加酸性 溶液,可验证该反应为可逆反应9. 常温下,下列说法正确的是( )A、pH均为3的醋酸和硫酸溶液,加水稀释相同倍数后, B、0.1mol·L-1HF溶液的pH=a,加入适量氟化钠固体后溶液的pH仍为a C、浓度均为0.1 的 溶液与 溶液中, 前者小于后者 D、0.1mol·L-1 溶液中,10. W、X、Y、Z是原子序数依次增大的短周期主族元素,其中W、X为非金属元素,Y,Z为金属元素,A是由其中两种元素组成的化合物。已知:电解A的熔融物能得到W的单质和Z的单质,且Z的单质能溶于Y的最高价氧化物对应水化物的溶液。下列说法正确的是( )A、四种元素的简单离子半径:X<W<Z<Y B、W与X的最简单氢化物的热稳定性:W>X C、Y与W能形成阴阳离子数之比为1∶2的两种化合物 D、Y、Z元素简单离子的氧化性:Z<Y11. 用电解法可以制备碘酸钾( ),装置如图所示。下列说法错误的是( )
+CO2↑+H2O
D、向 溶液中通入少量 气体:
8. 常温下,溴水与 溶液发生反应: ,若开始时 和 的浓度均为 ,达到平衡时 。假设溶液的体积无变化,下列有关说法错误的是( )A、加入 固体,平衡逆向移动 B、加入 振荡,平衡逆向移动,水层颜色变浅 C、常温下,该反应的平衡常数K的值约为5.1 D、向经苯萃取后的水层溶液中滴加酸性 溶液,可验证该反应为可逆反应9. 常温下,下列说法正确的是( )A、pH均为3的醋酸和硫酸溶液,加水稀释相同倍数后, B、0.1mol·L-1HF溶液的pH=a,加入适量氟化钠固体后溶液的pH仍为a C、浓度均为0.1 的 溶液与 溶液中, 前者小于后者 D、0.1mol·L-1 溶液中,10. W、X、Y、Z是原子序数依次增大的短周期主族元素,其中W、X为非金属元素,Y,Z为金属元素,A是由其中两种元素组成的化合物。已知:电解A的熔融物能得到W的单质和Z的单质,且Z的单质能溶于Y的最高价氧化物对应水化物的溶液。下列说法正确的是( )A、四种元素的简单离子半径:X<W<Z<Y B、W与X的最简单氢化物的热稳定性:W>X C、Y与W能形成阴阳离子数之比为1∶2的两种化合物 D、Y、Z元素简单离子的氧化性:Z<Y11. 用电解法可以制备碘酸钾( ),装置如图所示。下列说法错误的是( ) A、该装置为电能转化为化学能的装置 B、a极的电极反应式为 C、b极发生还原反应 D、阴极区每生成1mol气体转移2mol电子12. 某溶液A中可能大量含有 、 、 、 、 、 、 、 、 离子中的若干种,从A中分离所含金属元素的流程如图所示:
A、该装置为电能转化为化学能的装置 B、a极的电极反应式为 C、b极发生还原反应 D、阴极区每生成1mol气体转移2mol电子12. 某溶液A中可能大量含有 、 、 、 、 、 、 、 、 离子中的若干种,从A中分离所含金属元素的流程如图所示:
已知;Mn元素将以 形式进行分离,其余金属元素若从溶液中分离,都将以氢氧化物的形式析出,部分金属元素开始沉淀与完全沉淀的pH如下表:
物质
开始沉淀的pH
2.7
7.6
7.2
9.6
完全沉淀的pH
3.7
9.6
9.2
11.1
下列说法错误的是( )
A、溶液A呈强酸性,确定其中不能大量存在 、 B、滤渣1为 ,步骤①还一定发生反应 C、滤渣2为 ,滤液2中至少含有2种金属阳离子 D、溶液A中肯定存在 、 ,不能确定是否存在二、多选题
-
13. 常温下,用某浓度的NaOH溶液滴定20.00 mL等浓度的HA溶液,所得滴定曲线如图所示。下列说法错误的是( )
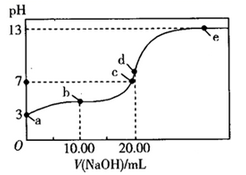 A、NaOH溶液的浓度是0.1 mol/L B、HA的 C、若向c点溶液中加入少量NaA固体,c(Na+)<c(A-) D、升高d点溶液的温度,溶液的碱性减弱14. 有机物M是一种药物的活性物质,其结构如图所示。下列有关M的说法错误的是( )
A、NaOH溶液的浓度是0.1 mol/L B、HA的 C、若向c点溶液中加入少量NaA固体,c(Na+)<c(A-) D、升高d点溶液的温度,溶液的碱性减弱14. 有机物M是一种药物的活性物质,其结构如图所示。下列有关M的说法错误的是( ) A、分子式为 B、含有醚键﹑碳碳双键等官能团 C、该分子中含有7个双键,故能发生加成反应 D、能使酸性 溶液、溴的 溶液褪色,且二者褪色的原理相同15. 下列有关实验操作对应的现象﹑解释或结论都正确的是( )
A、分子式为 B、含有醚键﹑碳碳双键等官能团 C、该分子中含有7个双键,故能发生加成反应 D、能使酸性 溶液、溴的 溶液褪色,且二者褪色的原理相同15. 下列有关实验操作对应的现象﹑解释或结论都正确的是( )选项
实验操作
现象
解释或结论
A
向酸性 溶液中通入
溶液紫色褪去
具有还原性
B
将常温下用冷的浓硝酸处理过的铝片插入硫酸铜溶液中
铝片表面无明显现象
用硝酸处理后,铝的金属性减弱
C
向试管中加入5mL10% 溶液,然后滴加5滴5%NaOH溶液,再向所得悬浊液中滴加葡萄糖溶液,加热煮沸
试管内产生砖红色沉淀
葡萄糖分子中含有醛基
D
向新制氯水中加入足量碳酸钙固体,然后用玻璃棒蘸取溶液于pH试纸上
氯水颜色变浅,pH试纸颜色褪去
加入碳酸钙后,氯水中的HCl被消耗,平衡 向右移动,HClO浓度增大,且HClO具有漂白性
A、A B、B C、C D、D三、非选择题
-
16. 常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
 已知:① 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
已知:① 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:、 。
② 和 在水中均可溶,在乙醇中均难溶。若向 溶液中加入乙醇,会析出 晶体。
请回答下列问题:
(1)、实验室用下图装置制备合成 所需的 溶液。
①仪器a的名称是;仪器d中发生反应的离子方程式是。
②说明检验装置A气密性的方法:。
③装置B的加热方法为水浴加热,其优点是。
(2)、方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有(填化学式)杂质,其原因是(从平衡移动的角度回答)。
(3)、方案2的实验步骤为:向 溶液中加入适量(填试剂名称),过滤、洗涤、干燥。(4)、方案1、2中步骤均有过滤、洗涤、干燥。①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:

减压过滤法相对于普通过滤法的优点为(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
17. 镍及硫酸镍在新型材料、新型电池的生产中有着十分广泛的应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备纯镍或硫酸镍的流程如下: 已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);②常温下溶度积常数: 、 。
(1)、步骤①所得炉气和炉渣均能使酸性高锰酸钾溶液褪色,其中炉渣能使酸性高锰酸钾溶液褪色的原因是;炉气使酸性高锰酸钾溶液褪色的离子方程式为。(2)、步骤③经相应溶剂萃取后得到NiSO4溶液的操作;在实验室中进行所需要使用的玻璃仪器有。(3)、步骤⑥以NiS(含CuS)作阳极、NiSO4溶液作电解液电解可在极(填“阳”或“阴”)获得粗镍,阳极的主要电极反应式为。粗镍的电解精炼需要将电解液的pH控制在2~5之间,下列有关说法错误的是(填序号)。A.防止溶液的酸性过强造成 放电,在阴极生成H2
B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中
(4)、化学上常认为残留在溶液中的离子浓度小于 时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+ , 若该溶液中的 ,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:。18. 控制CO2的排放是防止温室效应等不良气候现象产生的有效途径。(1)、高炉炼铁会排放大量的CO2和烟尘,必须进行严格的控制。已知:①3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g) △H=+a kJ/mol
②3C(石墨,s)+Fe2O3(s)=2Fe(s)+3CO(g) △H=+489.0 kJ/mol
③C(石墨,s)+CO2(g)=2CO(g) △H=+172.5 kJ/mol
则a=。若在恒温恒容密闭容器中发生反应①,当达到平衡后,充入CO2 , 则达到新平衡后CO的体积分数(填“增大”、“减小”或“不变”,下同),其转化率。
(2)、炼铁时需要用石灰石除去铁矿石中的脉石,该过程中涉及反应: 。若在恒温恒容的密闭容器中进行上述反应达到平衡状态,在t1时刻向平衡体系中充入1 mol CO2 , t2时刻反应重新达到平衡,画出t1时刻后的正逆反应速率随时间变化的图像。 (3)、CH4与CO2反应得到合成气的原理为 。某小组向体积是1 L的一密闭容器中充入物质的量均是1 mol的CH4与CO2 , 反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
(3)、CH4与CO2反应得到合成气的原理为 。某小组向体积是1 L的一密闭容器中充入物质的量均是1 mol的CH4与CO2 , 反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
①压强:p1p2(填“>”或“<”)。
②1100℃、p1条件下,20 min时反应达到平衡状态,则0~20 min内CH4的反应速率v(CH4)=mol/(L∙min),反应的平衡常数Kp=(用含p1的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(4)、通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
则A极的电极反应式为;若生成1 mol甲酸,则反应中转移电子的物质的量为mol。
19. 元素的金属性、非金属性及有关单质和化合物的性质与其原子结构、分子结构等有着密切的联系。回答。下列问题:(1)、下列基态原子的核外电子排布式正确的是 (填序号)。A、 B、 C、 D、(2)、第IA、IIA族部分元素氯化物的熔点如下表,从NaCl到CsCl熔点依次降低,但BeCl2的熔点比MgCl2的低,其原因是。氯化物
NaCl
KCl
RbCl
CsCl
熔点/℃
801
776
715
645
405
714
(3)、下列物质的变化破坏了极性共价键的是 (填序号)。乙酸中碳原子的杂化方式为 , 1 mol乙酸分子中含有的σ键和π键的个数比为;乙酸易溶于水的原因是相似相溶,以及。A.二氧化硅晶体熔化 B.乙酸溶于水 C.干冰升华 D.冰融化
(4)、某晶体的晶胞如图所示,则该晶体的化学式为;已知该晶体的晶胞边长为540 pm,阿伏加德罗常数的值为 ,则体积为10 cm3晶体的质量为 g(列出计算式即可)。 20. 盐酸氨溴索是目前临床上作用最强的祛痰药,以A、E为原料合成盐酸氨溴索(化合物K)的路线如下:
20. 盐酸氨溴索是目前临床上作用最强的祛痰药,以A、E为原料合成盐酸氨溴索(化合物K)的路线如下:
已知:①

②

回答下列问题:
(1)、E转化成F的试剂和条件是。盐酸氨溴索的分子式是。(2)、A→B的化学方程式是 , 其反应类型为 , B中含有官能团的名称是溴原子、。(3)、化合物J的结构简式是。(4)、有机物M是H的同分异构体,且M的核磁共振氢谱和红外光谱表明:①M分子中共有5种氢原子,其中苯环上的氢原子有2种;②M分子中有—COOH,则符合条件的M的结构有种(不考虑立体异构),写出其中一种的结构简式:。