河北省承德市2021年高考化学二模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 后母戊鼎是迄今世界上出土最大、最重的铜制礼器,享有“镇国之宝”的美誉。下列相关说法错误的是( )A、后母戊鼎由铜合金制成 B、后母戊鼎的熔点高于纯铜 C、碱式碳酸铜可用于干法炼铜 D、废弃铜制品属于可回收垃圾2. 中华文化源远流长,对人类进步和社会发展有着巨大影响。《徐光启手记》中载有强水的制备方法:“绿矾 五斤,硝 五斤。将矾炒去,(质量)约折五分之一。将二味同研细,用铁作锅,锅下起火……,开坛则药化为水,而锅亦坏矣。用水入五金皆成水,惟黄金不化水中,加盐(NaCl)则化……”。下列相关说法错误的是( )A、“炒”矾时绿矾失去全部结晶水 B、强水中加盐后形成王水能溶解金 C、硝的焰色试验中火焰呈紫色 D、制备强水过程中涉及氧化还原反应3. 新型羽毛球拍质轻、硬度和弹性好,由多种新材料制成,下列相关说法正确的是( )A、拍框中含有的中子数为14的铝原子符号为 B、拍杆中的碳纤维属于合成有机高分子材料 C、拍弦中的尼龙可通过缩聚反应制备 D、制拍用的环氧树脂单体中含有羟基4. 在生成和纯化硝基苯的实验过程中,下列操作未涉及的是( )A、
 B、
B、 C、
C、 D、
D、 5. 甲基丙烯酸(
5. 甲基丙烯酸( )是一种重要的有机合成单体,下列关于甲基丙烯酸的说法错误的是( ) A、分子式为 B、与丙烯酸互为同系物 C、分子中所有碳、氧原子可能处于同一平面 D、1mol甲基丙烯酸可与 发生加成反应6. 下列叙述和所作解释均正确的是( )
)是一种重要的有机合成单体,下列关于甲基丙烯酸的说法错误的是( ) A、分子式为 B、与丙烯酸互为同系物 C、分子中所有碳、氧原子可能处于同一平面 D、1mol甲基丙烯酸可与 发生加成反应6. 下列叙述和所作解释均正确的是( )选项
叙述
解释
A
可作食品干燥剂
具有很强的吸水性
B
浓硝酸保存在棕色试剂瓶
浓硝酸见光易分解
C
牺牲阳极的阴极保护法可用于钢铁防腐
钢铁不能在电解池阴极上得电子
D
可溶性铝盐能用于饮用水杀菌消毒
铝盐能吸附水中悬浮杂质
A、A B、B C、C D、D7. 科研工作者研究出二氧化碳催化氢化制甲酸的反应过程如图所示(其中M为过渡金属,R表示烷基)。
下列说法错误的是( )
A、 是反应的中间产物
B、二氧化碳催化氢化反应的原子利用率为100%
C、反应过程中M的成键数目保持不变
D、存在反应
是反应的中间产物
B、二氧化碳催化氢化反应的原子利用率为100%
C、反应过程中M的成键数目保持不变
D、存在反应  8. 常温下,在 氨水中加入 醋酸溶液。已知 溶液显中性,下列相关说法正确的是( )A、 的水解常数与 的电离常数相等 B、升高温度, 溶液的pH不变 C、当加入20.00mL醋酸溶液时,水的电离程度最大 D、整个滴定过程中始终存在9. 部分含碳物质的分类与相应碳元素的化合价关系如图所示。下列说法错误的是( )
8. 常温下,在 氨水中加入 醋酸溶液。已知 溶液显中性,下列相关说法正确的是( )A、 的水解常数与 的电离常数相等 B、升高温度, 溶液的pH不变 C、当加入20.00mL醋酸溶液时,水的电离程度最大 D、整个滴定过程中始终存在9. 部分含碳物质的分类与相应碳元素的化合价关系如图所示。下列说法错误的是( ) A、a中可能含有非极性键 B、b存在多种同素异形体 C、c不属于酸性氧化物 D、d转化为e可通过化合反应实现10. 硒(Se)是一种新型半导体材料,对富硒废料(含 、 )进行综合处理的一种工艺流程如下:
A、a中可能含有非极性键 B、b存在多种同素异形体 C、c不属于酸性氧化物 D、d转化为e可通过化合反应实现10. 硒(Se)是一种新型半导体材料,对富硒废料(含 、 )进行综合处理的一种工艺流程如下: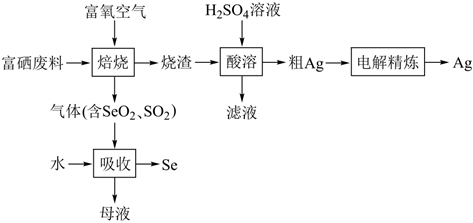
下列说法错误的是( )
A、合理处理富硒废料符合循环经济理念 B、母液可在“酸溶”工序循环利用 C、“滤液”经处理可制得胆矾 D、“电解精炼”装置中电解质适合选择AgCl11. 氨硼烷( ,B为+3价)是高能储氢燃料,由其制成的燃料电池性能稳定,放电效率高,工作原理如图所示。该电池工作时,下列说法正确的是( ) A、交换膜适合选择阴离子交换膜 B、电极M上的电势高于电极N上的电势 C、负极附近溶液的pH增大 D、导线中流过 ,正极区溶液质量增加1g12. 工业上用NaOH溶液进行 脱硫并制备高纯PbO的过程为 。已知 ;PbO的溶解度曲线如图所示。
A、交换膜适合选择阴离子交换膜 B、电极M上的电势高于电极N上的电势 C、负极附近溶液的pH增大 D、导线中流过 ,正极区溶液质量增加1g12. 工业上用NaOH溶液进行 脱硫并制备高纯PbO的过程为 。已知 ;PbO的溶解度曲线如图所示。
下列说法正确的是( )
A、PbO在NaOH溶液中的溶解是放热反应 B、碱浸1适宜用高浓度的NaOH溶液 C、降低NaOH溶液的浓度有利于PbO溶解 D、M点溶液中存在13. 一种可作为纺织品阻燃剂的化合物结构如图所示,其中M、W、X、Y、Z均为短周期主族元素且原子序数依次增大。下列说法错误的是( ) A、单质的氧化性: B、M、W、X形成的二元酸只有 C、M、W、Z三种元素可组成通常为气态的化合物 D、Y分别与X、Z形成的化合物中所有原子均满足8电子稳定结构
A、单质的氧化性: B、M、W、X形成的二元酸只有 C、M、W、Z三种元素可组成通常为气态的化合物 D、Y分别与X、Z形成的化合物中所有原子均满足8电子稳定结构二、多选题
-
14. 设 表示阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的中子数目为 B、密闭容器中1molHI分解后,容器内分子数目为 C、 与K充分反应转移的电子数目为 D、1L 稀硝酸中含有的氢离子数目为15. 利用如图所示装置进行实验,能达到相应实验目的的是( )
选项
①
②
③
实验目的

A
浓
蔗糖
品红溶液
检验是否有 生成
B
稀
某盐溶液
澄清石灰水
检验盐溶液中是否含有 或
C
浓盐酸
溶液
比较非金属性:Cl与S
D
浓
浓盐酸
悬浊液
比较 与
A、A B、B C、C D、D三、非选择题
-
16. 亚硝酰氯(NOCl)的沸点为-5.5℃,易水解生成两种酸,常用于有机合成。学习小组在实验室中对NO与 制备NOCl的反应进行了探究。回答下列问题:(1)、出于安全和环保考虑,制备反应的实验操作需在(条件)下进行。(2)、NO与 反应,装置如图所示(已知 溶液可以吸收NO)。

①关闭 ,打开 和分液漏斗活塞,至气球膨胀,目的为;连接B的目的为。
②关闭 ,打开 ,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为。
(3)、装置E中的试剂X为 , 作用为。(4)、测定NOCl的纯度。已知:实验前,D中 的体积为 (已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用 标准液滴定,达到滴定终点时消耗标准液体积为 。
①NaI发生反应的离子方程式为。
②达到滴定终点的现象为。
③本实验中NOCl的产率为。
17. 综合利用富钛废渣(含 、ZnO、 和少量有机物)制备锂离子电池正极材料中间体,并获得部分副产品的工艺流程如下: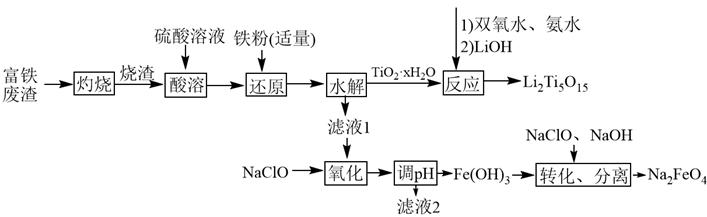
已知: 、 、 ,溶液中离子浓度 时认为该离子沉淀完全。回答下列问题:
(1)、“灼烧”的目的为;“酸溶”时用硝酸代替硫酸的不足之处为。(2)、若省略“还原”工序可能导致的后果为;当观察到现象时,即可停止加入铁粉。(3)、“酸溶”后钛以 形式存在,则“水解”反应的离子方程式为; 中过氧键的数目为。(4)、“氧化”后所得溶液中过渡金属离子浓度均为 ,则“调pH”的合理范围为。(5)、滤液2可用于制备活性ZnO,其方法为。(6)、“转化”反应的化学方程式为;以铁、石墨为电极,电解NaOH溶液也可制得 ,其中Fe作(填“阳极”或“阴极”),阳极的电极反应式为。18. 氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化加氢制备。已知:Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.部分化学键的键能如表所示。
化学键
键能
347.7
x
413.4
340.2
431.8
回答下列问题:
(1)、表中x=。(2)、较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为 充入 和 ,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为 ,10min达到平衡时 、HCl(g)的分压分别为 、 。① 内,反应的平均速率 (用分压表示,下同)。
② 的平衡转化率为。
③反应Ⅰ的平衡常数 。
(3)、高温度下,会发生反应Ⅲ而形成积碳,其可能导致的后果为(答出一点即可);不同压强下,向盛放催化剂的密闭容器中以物质的量之比为 充入 和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。 、 、 由大到小的顺序为;随温度升高,三条曲线逐渐趋于重合的原因为。 (4)、结合试验和计算机模拟结果,有学者提出乙炔选择性催化加氢的反应历程,如图2所示,其中吸附在催化剂表面的物种用“*”标注,TS表示过渡态。下列说法正确的是______(填选项字母)。A、该历程中的最大能垒为 B、存在非极性键断裂和极性键形成 C、选择不同催化剂,最大能垒不发生变化19. 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)、基态Co原子的价层电子排布图为;金属Co的熔点、沸点均高于金属K的原因为。(2)、 、 、 的键角由大到小的顺序为;C、N、O、F的第一电离能由大到小的顺序为。(3)、碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
(4)、结合试验和计算机模拟结果,有学者提出乙炔选择性催化加氢的反应历程,如图2所示,其中吸附在催化剂表面的物种用“*”标注,TS表示过渡态。下列说法正确的是______(填选项字母)。A、该历程中的最大能垒为 B、存在非极性键断裂和极性键形成 C、选择不同催化剂,最大能垒不发生变化19. 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)、基态Co原子的价层电子排布图为;金属Co的熔点、沸点均高于金属K的原因为。(2)、 、 、 的键角由大到小的顺序为;C、N、O、F的第一电离能由大到小的顺序为。(3)、碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
①冠醚中O原子的杂化形式为;H、C、O的电负性由小到大的顺序为。
② 不能镶入甲中而易镶入乙中的原因为。
(4)、 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。①每个晶胞中由K和F共同形成的正四面体空隙有个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于位置。
③若晶胞参数为a pm,阿伏加德罗常数的值为 ,晶体密度ρ= 。
20. 化合物M是一种医药中间体,实验室中M的一种合成路线如下:
已知:
①

②

③一个碳原子连接两个—OH不稳定,易自动脱水
回答下列问题:
(1)、A中官能团的名称为;B的化学名称为;由C生成D的反应类型为。(2)、F的结构简式为;由F生成G所需试剂和条件为。(3)、由G生成M的化学方程式为。(4)、Q为D的同分异构体,同时满足下列条件的Q的所有结构简式有种(不含立体异构)。①苯环上连有5个取代基;
②既含 ,又能与银氨溶液发生银镜反应。
(5)、参照上述合成路线和信息,以2-丙醇和苯为原料(无机试剂任选),设计制备 的合成路线。
的合成路线。