北京市西城区2021年高考化学一模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 下列材料的主要成分属于有机物的是( )A、国家速滑馆用于蒸发制冷的材料-二氧化碳 B、长征五号的整流罩前锥段材料-聚甲基丙烯酰亚胺 C、港珠澳大桥锚具材料-特殊工艺的低碳钢 D、我国自主研发的5G芯片的材料-硅2. 下列反应中,酸体现还原性的是( )A、 与浓盐酸共热制 B、 与浓硫酸共热制 C、 与稀硫酸反应制 D、 与稀硝酸反应制备3. 工业上利用反应 检查氯气管道是否漏气。下列说法错误的是( )A、将浓氨水接近管道,若产生白烟说明管道漏气 B、 的电子式为:
 C、 中只含有离子键
D、该反应中氧化剂和还原剂的物质的量之比为
4. 元素周期律的发现是近代化学史上的一座里程碑。下列事实不能用元素周期律解释的是( )A、 溶液中加盐酸,产生气泡 B、常温下,形状和大小相同的 、 与同浓度盐酸反应, 条更剧烈 C、气态氢化物的稳定性: D、 从 溶液中置换出5. 下列关于室温下 溶液的说法正确的是( )A、 的电离方程式: B、加入少量 固体后,溶液的 增大 C、滴加稀盐酸的过程中, 增大 D、与 溶液反应的离子方程式:6. 某小组用如图装置探究 的性质。下列离子方程式书写错误的是( )
C、 中只含有离子键
D、该反应中氧化剂和还原剂的物质的量之比为
4. 元素周期律的发现是近代化学史上的一座里程碑。下列事实不能用元素周期律解释的是( )A、 溶液中加盐酸,产生气泡 B、常温下,形状和大小相同的 、 与同浓度盐酸反应, 条更剧烈 C、气态氢化物的稳定性: D、 从 溶液中置换出5. 下列关于室温下 溶液的说法正确的是( )A、 的电离方程式: B、加入少量 固体后,溶液的 增大 C、滴加稀盐酸的过程中, 增大 D、与 溶液反应的离子方程式:6. 某小组用如图装置探究 的性质。下列离子方程式书写错误的是( ) A、甲中紫色褪去: B、乙中蓝色逐渐变浅: C、丙中产生少量白色沉淀: D、丁中可能的反应:7. 下列说法正确的是( )A、标准状况下, 含有的分子数约为 B、 含有的中子数约为 C、 和 的混合物中含有的氮原子数共约为 D、 与足量的 反应转移的电子数约为8. 新鲜水果和蔬菜中富含维生素 ,在 作用下可转化为脱氢维生素 ,原理如图:
A、甲中紫色褪去: B、乙中蓝色逐渐变浅: C、丙中产生少量白色沉淀: D、丁中可能的反应:7. 下列说法正确的是( )A、标准状况下, 含有的分子数约为 B、 含有的中子数约为 C、 和 的混合物中含有的氮原子数共约为 D、 与足量的 反应转移的电子数约为8. 新鲜水果和蔬菜中富含维生素 ,在 作用下可转化为脱氢维生素 ,原理如图:

下列关于维生素 的说法正确的是( )
A、分子式为 B、难溶于水,易溶于有机溶剂 C、与脱氢维生素 都可使酸性 溶液褪色 D、与脱氢维生素 互为同分异构体9. 下列实验方案能达到相应目的的是( )A
B
C
D




除去 中的
相同温度下的溶解度:
检验溴乙烷水解产物中含有
检验 溶液是否变质
A、A B、B C、C D、D10. Claiscn重排反应是有机合成中常用的重要反应。以 为例,其反应过程对应的机理有两种,如图(“ ”可表示单,双键),下列说法错误的是( ) A、机理1:反应物→产物的过程中,有极性共价键断裂 B、机理2:反应物→中间体的过程中,没有化学键断裂,只有空间结构变化 C、该反应的化学方程式: D、相比于机理1,机理2所需活化能降低,活化分子百分比下降,反应速率减慢11. 一种新型高分子 的合成方法如图:
A、机理1:反应物→产物的过程中,有极性共价键断裂 B、机理2:反应物→中间体的过程中,没有化学键断裂,只有空间结构变化 C、该反应的化学方程式: D、相比于机理1,机理2所需活化能降低,活化分子百分比下降,反应速率减慢11. 一种新型高分子 的合成方法如图: 下列说法错误的是( )A、酪氨酸能与酸、碱反应生成盐 B、 环二肽最多能与 反应 C、高分子 中含有
下列说法错误的是( )A、酪氨酸能与酸、碱反应生成盐 B、 环二肽最多能与 反应 C、高分子 中含有 结构片段
D、高分子 在环境中可降解为小分子
12. 利用废铝箔(主要成分为 ,含少量 、 等)制明矾 的一种工艺流程如图:
结构片段
D、高分子 在环境中可降解为小分子
12. 利用废铝箔(主要成分为 ,含少量 、 等)制明矾 的一种工艺流程如图:
下列说法错误的是( )
A、①中生成了 : B、操作 是过滤,以除去难溶于 溶液的杂质 C、②③中加入稀硫酸的作用均是除去杂质 D、由④可知,室温下明矾的溶解度小于 和 的溶解度13. 一定温度下,容积为 的密闭容器中发生反应: ,容器中部分物质的含量见表( ):反应时间/
0
1.2
0.6
0
0
0.8
0.2
下列说法正确的是( )
A、 内, 的平均化学反应速率为 B、该温度下,反应的化学平衡常数 C、达到化学平衡状态时, 的转化率为 D、若升高温度,平衡逆向移动14. 相同温度和压强下,研究 在不同溶液中的溶解度(用溶解 的物质的量浓度表示)随溶液浓度的变化。在 溶液和盐酸中 的溶解度以及各种含氯微粒的浓度变化如图。 下列说法错误的是( )A、由图1可知, 溶于 溶液时还发生了反应 B、随 溶液浓度增大, 平衡逆移, 溶解度减小 C、随盐酸浓度增加 与 的反应被抑制,生成 为主要反应从而促进 溶解 D、由上述实验可知, 浓度增大促进 溶解,由此推知在稀硫酸中,随硫酸浓度增大 的溶解度会增大
下列说法错误的是( )A、由图1可知, 溶于 溶液时还发生了反应 B、随 溶液浓度增大, 平衡逆移, 溶解度减小 C、随盐酸浓度增加 与 的反应被抑制,生成 为主要反应从而促进 溶解 D、由上述实验可知, 浓度增大促进 溶解,由此推知在稀硫酸中,随硫酸浓度增大 的溶解度会增大二、非选择题
-
15. ( 的储存和还原在不同时段交替进行)技术时有效降低稀燃柴油和汽油发动机尾气中 的排放,其工作原理如图。
 (1)、已知:
(1)、已知:则 技术工作原理的热化学方程式: 。
(2)、①存储阶段: 存储 后转化为 的化学方程式是。②还原阶段: 从 中释放,然后在 的表面被 、 还原为 。若参加反应的 ,则反应的 。
(3)、某实验小组模拟 系统中的一个存储、还原过程,让尾气通过 反应器,测得过程中出口 浓度变化如图。
① 时刻前, 的浓度接近0,原因是。
② 时刻,切换至贫氧条件。 的浓度急剧上升又快速下降的原因是。
16. 羟胺( )为无色固体,结构可视为 替代 中1个 ,羟胺具有和 类似的弱碱性,可以与盐酸反应生成盐酸羟胺( ),盐酸羟胺是一种盐,易溶于水,溶解后完全电离为 和 。(1)、 中 元素的化合价是。(2)、过氧化氢催化氧化氨水法制备盐酸羟胺的原理如下:步骤1:
 +NH3+H2O2 X+2H2O
+NH3+H2O2 X+2H2O步骤2:X+HCl+H2O⇌NH2OH HCl+

资料:丙酮(
 )是一种易溶于水的无色液体,沸点为 。
)是一种易溶于水的无色液体,沸点为 。① 的分子式为 ,其核磁共振氢谱只有两个吸收峰,红外光谱显示其分子结构中存在羟基和碳氮双键。 的结构简式是。
②步骤1中,相同反应时间氨的转化率随温度变化如图1。温度高于 时,随温度上升氨的转化率变化的原因是。

③步骤2中,在密闭容器中反应时, 的平衡转化率随温度变化如图2。该反应为(填“吸热”或“放热”)反应。

④步骤2中蒸馏出丙酮的目的是(1点即可)。
(3)、电化学法制备盐酸羟胺:向两侧电极分别通入 和 ,以盐酸为电解质,组装原电池以制备盐酸羟胺。装置(图3)和正极反应机理图(图4):
 ①将图4方框中缺失的物质补充完整。
①将图4方框中缺失的物质补充完整。②一段时间后,正极区的 与反应前相比(填“增大”、“减小”或“不变”)(不考虑溶液体积的变化)。
17. 米格列奈可用于治疗糖尿病,其合成路线如图: 已知:i.
已知:i. 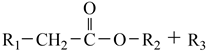 +R3-CHO H2O+
+R3-CHO H2O+ 
ii.
 H2O+
H2O+ 
iii.
 +R8-NH2
+R8-NH2  (1)、 能与 溶液反应生成气体, 中含有的官能团是。(2)、 的化学方程式是。(3)、 的结构简式是。(4)、试剂 为 ,其名称是。(5)、 的反应类型是。(6)、 米格列奈的过程中,会生成 , 与米格列奈互为碳链异构的同分异构体,则 的结构简式是。(7)、酸性溶液中,可采用电解法由 制 ,电解时的阴极反应式是。18. 海水中的化学资源具有巨大的开发潜力。(1)、溴及其化合物广泛用于医药、塑料阻燃剂等。苦卤(含 )提溴的工业流程如图:
(1)、 能与 溶液反应生成气体, 中含有的官能团是。(2)、 的化学方程式是。(3)、 的结构简式是。(4)、试剂 为 ,其名称是。(5)、 的反应类型是。(6)、 米格列奈的过程中,会生成 , 与米格列奈互为碳链异构的同分异构体,则 的结构简式是。(7)、酸性溶液中,可采用电解法由 制 ,电解时的阴极反应式是。18. 海水中的化学资源具有巨大的开发潜力。(1)、溴及其化合物广泛用于医药、塑料阻燃剂等。苦卤(含 )提溴的工业流程如图:苦卤(含Br)
 →吸收塔 蒸馏塔 液溴
→吸收塔 蒸馏塔 液溴①向吹出塔中通空气的目的是。
②吸收塔中盛有 溶液,通入足量 蒸气时,有 和无色气体生成,反应的离子方程式是。
(2)、用如图所示装置( 表示斜发沸石)分离海水中的 和 ,料液(含 、 、 和 )先流过斜发沸石吸附 和 。然后通电,双极膜产生的 将 交换下来, 将 交换下来,得到 溶液。
表示斜发沸石)分离海水中的 和 ,料液(含 、 、 和 )先流过斜发沸石吸附 和 。然后通电,双极膜产生的 将 交换下来, 将 交换下来,得到 溶液。 
①简述 溶液中含 不含 的原因:。
②海水中 ,则 溶液中的溶质是。为了提高产率并防止原料浪费,通电一段时间后,将阴、阳极的斜发沸石对调,继续通电,此时斜发沸石内主要反应的离子方程式是。
(3)、 广泛用于皮肤科、眼科等疾病的治疗。利用海水中获得的 和(2)中获得的 溶液及 粉,可获得纯度较高的 晶体,流程如图:A溶液 溶液1(pH为6~7) 溶液2 KI晶体
已知:i. 的溶解度
温度/
6
20
60
100
的溶解度/
128
140
176
206
ii.
①用化学方程式说明加入 粉的作用:。
②操作1是 , 过滤,洗涤,干燥。
19. 某小组同学根据 、 和 的氧化性推断溶液中 与 可能先后发生两个反应: , ,进行如下实验。实验
试剂
现象
Ⅰ
溶液、过量锌粉
黄色溶液很快变浅,接着有无色气泡产生,固体中未检出铁
Ⅱ
的 溶液、过量锌粉
片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁
(1)、取实验Ⅰ反应后的少量溶液,滴加几滴 溶液,生成 , 证明有 。(2)、结合化学用语解释实验Ⅱ中产生红褐色浑浊的原因:。(3)、实验Ⅲ,用 溶液和 溶液替代实验Ⅱ中的 溶液:实验
试剂
现象
Ⅰ
的 溶液、过量锌粉
约半小时后,溶液变为深棕色且浑浊,无铁产生
Ⅱ
的 溶液、过量锌粉
约半小时后,溶液呈浅绿色且浑浊,有少量铁产生
资料: , 在溶液中呈棕色。
①a=。
②有人认为Ⅰ中深棕色溶液中存在 ,设计实验证明。实验的操作和现象是。
③对照实验Ⅱ和Ⅲ, 溶液与过量锌粉反应没有生成铁的原因是。
(4)、实验Ⅳ:将实验Ⅱ中 水溶液换成 无水乙醇溶液,加入足量锌粉,刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅳ可知:锌能否与 反应得到单质铁,与 和 的物质的量、 的浓度、、等有关。