北京市石景山区2021年高考化学一模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 化学是材料科学、生命科学、环境科学、能源科学和信息科学等的重要基础。下列过程没有涉及化学变化的是( )A、煤的脱硝脱硫 B、风力发电 C、以黏土为原料烧结陶瓷 D、以N2为原料合成氨及铵盐2. 实验室配制250 mL 0.1mol/L的Na2CO3溶液,无需用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列关于元素及元素周期律的说法,正确的是( )A、同主族元素的原子,最外层电子数相等且等于主族序数 B、铝元素在周期表中位于第4周期ⅢA族 C、 Be的原子核内中子数是10 D、第117号元素Ts的非金属性强于Br4. 下列解释实验事实的化学方程式正确的是( )A、大理石溶于盐酸: + 2H+ = H2O + CO2↑ B、用FeCl3溶液“腐蚀”覆铜板:Fe3++ Cu = Fe2++ Cu2+ C、小苏打溶液呈弱碱性:HCO + H2O H2CO3 + OH- D、“84消毒液”中加少量醋酸可增强其漂白性:ClO-+ H+ = HClO5. NaN3是汽车安全气囊系统中普遍使用的物质之一。当汽车受到猛烈碰撞时,瞬间引发反应:2NaN3 = 2Na + 3N2↑,同时释放大量的热。NaN3为离子化合物,下列说法正确的是( )A、生成3 mol N2时,转移2 mol电子 B、1个 中含有21个电子 C、NaN3中只含离子键 D、N2的电子式为 N⋮⋮N6. 实验小组设计图所示装置,验证SO2性质,对实验现象分析错误的是( )
3. 下列关于元素及元素周期律的说法,正确的是( )A、同主族元素的原子,最外层电子数相等且等于主族序数 B、铝元素在周期表中位于第4周期ⅢA族 C、 Be的原子核内中子数是10 D、第117号元素Ts的非金属性强于Br4. 下列解释实验事实的化学方程式正确的是( )A、大理石溶于盐酸: + 2H+ = H2O + CO2↑ B、用FeCl3溶液“腐蚀”覆铜板:Fe3++ Cu = Fe2++ Cu2+ C、小苏打溶液呈弱碱性:HCO + H2O H2CO3 + OH- D、“84消毒液”中加少量醋酸可增强其漂白性:ClO-+ H+ = HClO5. NaN3是汽车安全气囊系统中普遍使用的物质之一。当汽车受到猛烈碰撞时,瞬间引发反应:2NaN3 = 2Na + 3N2↑,同时释放大量的热。NaN3为离子化合物,下列说法正确的是( )A、生成3 mol N2时,转移2 mol电子 B、1个 中含有21个电子 C、NaN3中只含离子键 D、N2的电子式为 N⋮⋮N6. 实验小组设计图所示装置,验证SO2性质,对实验现象分析错误的是( )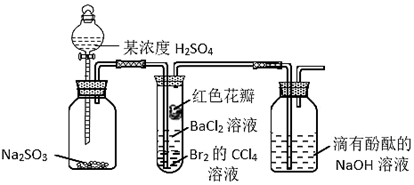 A、试管内Br2的CCl4溶液褪色,说明SO2具有还原性 B、一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3 C、试管中的红色花瓣褪色,说明SO2具有漂白性 D、滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应7. 下列各项比较中,相等的是( )A、相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-) B、相同质量的乙炔和苯中所含的氢原子数 C、相同物质的量的Cl2分别与足量的Fe、Ca(OH)2充分反应转移电子数 D、标准状况下,相同体积的NO和NO2所含氧原子数8. 氢化亚铜(CuH)是一种红棕色的难溶物,可在40℃~50℃时用CuSO4溶液和“另一种反应物”制取。CuH在Cl2中能燃烧生成CuCl2和HCl;CuH跟盐酸反应生成CuCl难溶物和H2。下列推断错误的是( )A、“另一种反应物”在反应中表现还原性 B、CuH与Cl2反应的化学方程式为:2CuH + 3Cl2 2CuCl2 + 2HCl C、CuH与Cl2反应时,CuH做还原剂 D、CuH与盐酸反应的离子方程式为:CuH + H+ = Cu+ + H2↑9. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如图:
A、试管内Br2的CCl4溶液褪色,说明SO2具有还原性 B、一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3 C、试管中的红色花瓣褪色,说明SO2具有漂白性 D、滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应7. 下列各项比较中,相等的是( )A、相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-) B、相同质量的乙炔和苯中所含的氢原子数 C、相同物质的量的Cl2分别与足量的Fe、Ca(OH)2充分反应转移电子数 D、标准状况下,相同体积的NO和NO2所含氧原子数8. 氢化亚铜(CuH)是一种红棕色的难溶物,可在40℃~50℃时用CuSO4溶液和“另一种反应物”制取。CuH在Cl2中能燃烧生成CuCl2和HCl;CuH跟盐酸反应生成CuCl难溶物和H2。下列推断错误的是( )A、“另一种反应物”在反应中表现还原性 B、CuH与Cl2反应的化学方程式为:2CuH + 3Cl2 2CuCl2 + 2HCl C、CuH与Cl2反应时,CuH做还原剂 D、CuH与盐酸反应的离子方程式为:CuH + H+ = Cu+ + H2↑9. “中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如图:
下列说法错误的是( )
A、反应①中氧化剂和还原剂之比为1:2 B、流程中HCl和H2可以循环利用 C、反应①②③均为置换反应 D、由②③反应推测,③为放热反应10. H2O2是重要的绿色消毒液和氧化剂,研究其分解反应有重要意义。在含有少量I-的溶液中,H2O2分解的机理是:ⅰ.H2O2 + I-= H2O + IO-;ⅱ.H2O2 + IO-=H2O + O2↑+ I-。分解反应过程中能量变化如图所示,下列判断错误的是( ) A、I-改变了H2O2分解的路径,曲线②为含有I-的反应过程 B、反应i和ii均为放热过程 C、反应i的反应速率比反应ii慢 D、I-不能改变总反应的能量变化11. 为了减少白色污染,科学家合成了PLA塑料,其结构片段如图所示(图中
A、I-改变了H2O2分解的路径,曲线②为含有I-的反应过程 B、反应i和ii均为放热过程 C、反应i的反应速率比反应ii慢 D、I-不能改变总反应的能量变化11. 为了减少白色污染,科学家合成了PLA塑料,其结构片段如图所示(图中 表示链延长)。下列说法错误的是( )
表示链延长)。下列说法错误的是( )  A、PLA聚合物的链节为
A、PLA聚合物的链节为 B、PLA可由
B、PLA可由  通过缩聚反应制得
C、PLA制取过程中可能生成副产物
通过缩聚反应制得
C、PLA制取过程中可能生成副产物  D、PLA相比于聚氯乙烯塑料的优点是易降解
12. 外加少量酸或碱而pH基本不变的溶液,称为缓冲溶液。人体血液存在H2CO3/HCO 的缓冲体系,能消耗人体正常代谢产生的酸或碱,保持pH的稳定。已知人体血液在正常体温时,H2CO3的一级电离常数Ka1=1×10-6。下列说法错误的是( )A、人体血液存在缓冲作用可用平衡表示:H++HCO H2CO3 CO2+H2O B、人体血液在酸中毒时,可注射少量NaHCO3溶液缓解 C、代谢产生的H+与HCO 结合形成H2CO3来维持血液pH的稳定 D、某血液中c(HCO ):c(H2CO3) ≈ 20:1,则c(H+) ≈ 5×10-7mol/L13. 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
D、PLA相比于聚氯乙烯塑料的优点是易降解
12. 外加少量酸或碱而pH基本不变的溶液,称为缓冲溶液。人体血液存在H2CO3/HCO 的缓冲体系,能消耗人体正常代谢产生的酸或碱,保持pH的稳定。已知人体血液在正常体温时,H2CO3的一级电离常数Ka1=1×10-6。下列说法错误的是( )A、人体血液存在缓冲作用可用平衡表示:H++HCO H2CO3 CO2+H2O B、人体血液在酸中毒时,可注射少量NaHCO3溶液缓解 C、代谢产生的H+与HCO 结合形成H2CO3来维持血液pH的稳定 D、某血液中c(HCO ):c(H2CO3) ≈ 20:1,则c(H+) ≈ 5×10-7mol/L13. 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
名称
熔点/℃
沸点/℃
燃烧热
∆H /kJ•mol-1
正戊烷
-130
36
–3506.1
异戊烷
-159.4
27.8
–3504.1
下列说法错误的是( )
A、25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol B、28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 C、36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 D、150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变14. 某小组对Fe2+和Ag+的反应进行了如下探究实验:操作
现象
Ag+ 浓度变化曲线
实验Ⅰ
向1 mL 0.1 mol/L FeSO4溶液中加入1 mL 0.1 mol/L AgNO3溶液
几分钟后,出现大量灰黑色浑浊

实验Ⅱ
先向试管中加入几滴Fe2(SO4)3溶液,然后重复实验Ⅰ的操作
现象与实验Ⅰ相同
(已知:Ag2SO4为白色微溶物;反应过程中测得温度几乎无变化)
下列说法正确的是( )
A、实验Ⅰ只发生反应:Fe2++Ag+⇌Fe3++Ag,灰黑色浑浊是Ag B、图中c(Ag+)由a→b急速变化的可能原因是反应放热 C、图中c(Ag+)由a→b急速变化的可能原因是生成的Ag起催化作用 D、图中c(Ag+)由a→b急速变化的可能原因是生成的Fe3+起催化作用二、非选择题
-
15. 《本草纲目》记载红曲米有特殊功效,受此启发有学者从红曲米中分离出具有降脂功能的有效成分——洛伐他汀,之后科学家合成了多种他汀类药物。“匹伐他汀钙”是人工合成的一种他汀类药物,其合成路线如下:
 已知:
已知:  (1)、A是一种芳香烃,A的名称是。(2)、由B生成C的反应类型是。(3)、D→E的化学方程式是。(4)、F的结构简式是。(5)、D的同分异构体中,满足下列条件的有种。
(1)、A是一种芳香烃,A的名称是。(2)、由B生成C的反应类型是。(3)、D→E的化学方程式是。(4)、F的结构简式是。(5)、D的同分异构体中,满足下列条件的有种。①与FeCl3作用显色;②能够发生银镜反应。
写出其中一种同分异构体的结构简式。
(6)、H含有2个苯环,核磁共振氢谱图中有7组峰,且面积比为2:2:2:1:1:1:1,G→H的化学方程式是。(7)、H→I反应中生成中间体L,L含有3 个六元环,1 mol的L转化成I 需要脱去2 mol水,L的结构简式是。16. 化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:(1)、用氯气制备漂白液的离子方程式是。(2)、TCCA是一种高效含氯消毒漂白剂,贮运稳定,在水中释放有效氯时间长,应用于游泳池等公共场合,其分子结构如图所示:
已知:X、Y、Z、W属于原子序数递增的短周期元素,Z核外最外层电子数是电子层数的3倍。
①TCCA的分子式是。
②X、Y、Z对应简单氢化物中热稳定性最强的是(用氢化物的化学式表示)。
(3)、ClO2和NaClO2均为重要的杀菌消毒剂,将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2。资料:NaClO2晶体易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
① 写出由ClO2制备NaClO2的离子方程式。
② 从上述NaClO2溶液获得干燥的NaClO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后, , , 低于60℃干燥,得到NaClO2晶体 (补全实验步骤)。
17. 将CO2还原成甲烷,是实现CO2资源化利用的有效途径之一。(1)、I.CO2甲烷化CO2甲烷化过程可能发生反应:
ⅰ.CO2(g) + 4H2(g) CH4(g) + 2H2O(g) ΔH1
ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
ⅲ.CO(g) + 3H2(g) CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
……
ΔH1= kJ∙mol−1。
(2)、不同条件下,按照n(CO2):n(H2)=1:4投料,CO2的平衡转化率如图所示。

①压强p1、p2、p3由大到小的顺序是。
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因。
(3)、Ⅱ.微生物电化学法微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如上图所示。
阴极的电极反应式是。
(4)、若生成1 mol CH4 , 理论上阳极室生成CO2的体积是L(标准状况,忽略气体的溶解)。18. 重铬酸钾在工业中有广泛的应用,可用铬铁矿为原料制备。以铬铁矿(主要成分可表示为FeO·Cr2O3 , 还含有SiO2、Al2O3、Fe2O3等杂质)制备重铬酸钾(K2Cr2O7)固体的工艺流程如下:
资料:① NaFeO2遇水强烈水解。
② 。
(1)、K2Cr2O7中Cr元素的化合价是。(2)、步骤①发生多个反应,补全下列化学方程式:FeO·Cr2O3 + Na2CO3 +KClO3 =12Na2CrO4 +Fe2O3 +CO2 +KCl
(3)、熔块的主要成分为Na2CrO4、NaFeO2、Na2SiO3和NaAlO2等可溶性盐,滤渣1为红褐色固体,写出步骤②NaFeO2水解的离子方程式。(4)、结合化学用语解释步骤④调pH的目的。(5)、重铬酸钾纯度测定称取重铬酸钾试样2.9400 g配成250 mL溶液,取出25.00 mL于锥形瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(Cr2O 的还原产物为Cr3+),放于暗处5 min,然后加入100 mL水和淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2 + 2S2O = 2I- + S4O )。
①滴定终点的颜色变化是。
②若实验共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度是(滴定过程中其它杂质不参与反应)。
19. 亚硝酸钠(NaNO2)是一种常见的食品添加剂。某实验小组制备NaNO2并对其性质进行探究。资料:Ag+与NO 反应,可生成AgNO2白色沉淀或无色配离子。
(1)、Ⅰ. NaNO2的制取(夹持装置略)实验i

向装置A中通入一段时间N2 , 再通入NO和NO2混合气体,待Na2CO3反应完全后,将所得溶液经系列操作,得到NaNO2白色固体。
仪器a的名称是。
(2)、制取NaNO2的离子方程式是。(3)、小组成员推测HNO2是弱酸。为证实推测,向NaNO2溶液中加入试剂X,“实验现象”证实该推测合理,加入的试剂及现象是。(4)、Ⅱ. NaNO2性质探究将实验ⅰ制取的NaNO2固体配制成约0.1 mol/L NaNO2溶液,进行实验ⅱ和ⅲ。
实验ii

①由实验ⅱ的现象得出结论:白色沉淀的生成与有关。
②仅用实验ⅱ的试剂,设计不同实验方案进一步证实了上述结论,实验操作及现象是。
(5)、① 酸性条件下,NO 氧化I-的离子方程式是。实验iii

②甲同学认为,依据实验ⅲ的现象可以得出结论:该条件下,NO 能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO ,实验iv的实验方案是。