浙教版科学九年级上学期期中测试二
试卷更新日期:2016-09-21 类型:期中考试
一、选择题
-
1. 小科同学在不同季节的制作过程中,一定发生了化学变化的是( )A、春天花朵掰成花瓣 B、夏天粮食酿成美酒 C、秋天水果榨成果汁 D、冬天冰砖凿成冰雕2. 下列物质之间不能发生化学反应的是( )A、石灰水与稀盐酸 B、铜与硝酸银溶液 C、银与稀硫酸 D、二氧化碳与水3. 下列属于复合肥料的是( )A、NaNO3 B、K2SO4 C、NH4H2PO4 D、Ca3(PO4)24. 我们每天扔掉的垃圾中,很多是宝贵的再生资源,因此生活中的垃圾要分类回收。下列物质中,属于可回收物的是( )
①纸张 ②塑料 ③玻璃 ④金属
A、①②③ B、①③④ C、②③④ D、①②③④5. 自行车、电动自行车、普通汽车消耗的能量类型分别是( )①内能 ②核能 ③电能 ④太阳能 ⑤化学能
A、①④③ B、①③① C、①②③ D、⑤③⑤6. 用石灰石、水、纯碱为原料制取烧碱,所发生的反应都不属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应7. 下列鉴别物质所用的方法或试剂,错误的是( )A、氧气和氮气-观察颜色 B、铁粉和炭粉-用稀硫酸 C、羊毛和化学纤维-点燃闻气味 D、氢氧化钠溶液和水-用酚酞溶液8. 下列有关说法中不正确的是( )A、酸溶液中都含有H+ , 所以有相似的化学性质 B、酸、碱在水溶液中都可解离出带电的粒子 C、在实验室,常用浓硫酸来干燥某些气体 D、医疗上的生理盐水是0.9%的纯碱溶液9. 下列有关金属及合金的说法中正确的是( )A、合金是由两种或两种以上金属熔合而成的具有金属特性的物质 B、在日常生活中,大量使用的常常不是纯金属,而是它们的合金 C、“真金不怕火炼”说明黄金的硬度非常大 D、铜的化学性质不活泼,所以铜制品不会生锈10. 将一定量的锌粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,将滤渣放入稀盐酸溶液里,有气泡产生。则下列情况不可能存在的是( )A、滤渣是Ag、Cu、Zn B、滤液中含有Zn2+、Mg2+、NO C、滤渣是Ag、Cu、Mg D、金属活动性顺序是Ag<Cu<Zn<Mg11. 如图所示是蹦床运动员表演的情景,运动员从最低点到达最高点的过程中,运动员的动能和重力势能变化情况分别是( ) A、动能减小,重力势能增大 B、动能增大,重力势能减小 C、动能先增大后减小,重力势能增大 D、动能先减小后增大,重力势能减小12. “类推”是学习化学的常用方法,下列推理正确的是( )A、碳可用于炼铁,故碳可用于冶炼所有的金属 B、酸的溶液pH<7,故pH<7的溶液一定是酸的溶液 C、镁条在空气中燃烧生成白色固体,故铜片在空气中的灼烧也生成白色固体 D、酸和碱生成盐和水的反应属于中和反应,故盐酸和氢氧化钠溶液能发生中和反应13. 碱石灰是NaOH和CaO的混合物,取一定量露置于空气中部分变质的碱石灰,加水充分搅拌后过滤,所得物质成分可能是( )
A、动能减小,重力势能增大 B、动能增大,重力势能减小 C、动能先增大后减小,重力势能增大 D、动能先减小后增大,重力势能减小12. “类推”是学习化学的常用方法,下列推理正确的是( )A、碳可用于炼铁,故碳可用于冶炼所有的金属 B、酸的溶液pH<7,故pH<7的溶液一定是酸的溶液 C、镁条在空气中燃烧生成白色固体,故铜片在空气中的灼烧也生成白色固体 D、酸和碱生成盐和水的反应属于中和反应,故盐酸和氢氧化钠溶液能发生中和反应13. 碱石灰是NaOH和CaO的混合物,取一定量露置于空气中部分变质的碱石灰,加水充分搅拌后过滤,所得物质成分可能是( )选项
A
B
C
D
滤液中的溶质
NaOH
NaOH
Ca(OH)2
NaOH
Na2CO3
Na2CO3
滤渣
Ca(OH)2
CaCO3
Ca(OH)2
CaCO3
Ca(OH)2
CaCO3
A、A B、B C、C D、D14. 某溶液由NaOH,HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( ) A、HCl和H2SO4一定存在 B、NaOH,H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在,NaOH,H2SO4一定不存在,MgCl2可能存在15. 天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的稀硫酸,此时天平平衡,将等质量的MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错误的是( )A、若天平不平衡,指针一定偏向加Na2CO3的一边 B、若天平不平衡,两种碳酸盐一定都没有剩余 C、若天平平衡,两烧杯中的酸一定完全反应 D、若反应后Na2CO3有剩余,天平一定平衡
A、HCl和H2SO4一定存在 B、NaOH,H2SO4和MgCl2一定不存在 C、HCl和MgCl2一定存在 D、HCl一定存在,NaOH,H2SO4一定不存在,MgCl2可能存在15. 天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的稀硫酸,此时天平平衡,将等质量的MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错误的是( )A、若天平不平衡,指针一定偏向加Na2CO3的一边 B、若天平不平衡,两种碳酸盐一定都没有剩余 C、若天平平衡,两烧杯中的酸一定完全反应 D、若反应后Na2CO3有剩余,天平一定平衡二、填空题
-
16. 硫酸和盐酸都是实验室常用的酸,它们有许多相似的性质。(1)、水溶液的pH都7(填“大于”、“小于”或“等于”);(2)、都能除去铁锈,将生锈的铁钉放入稀盐酸中,可看到铁锈逐渐消失,溶液颜色变为。17. 如图是自动回转的“魔罐”,橡皮筋两头分别固定在罐子的顶部和底部,中间系一个钩码,当你将“魔罐”在水平地面上滚出后,它能自动滚回来的原因是能转化为能。
 18. 分类学习是化学学习中常用的方法,通过按一定标准分类研究,往往可以收到事半功倍的效果。仅含碳和氢两种元素的有机物称为烃,如烷烃、烯烃、炔烃等.烷烃中最简单的是甲烷(CH4),其余随碳原子数的增加,依次为乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等。如果烷烃中的碳原子数为n,则烷烃的化学式可以用通式表示。它们在氧气中完全燃烧的产物都是二氧化碳和水,试写出甲烷在空气中充分燃烧的化学方程式:。19. 分析、归纳、总结是学习科学的有效方法。在C+2CuO 高温 2Cu+CO2↑与CO+CuO △ Cu+CO2两个反应中,C和CO都是将CuO还原为Cu的物质,故在该反应中作还原剂。(1)、上述两个反应中还原剂的化合价变化规律:;(2)、根据你的规律,判断反应Fe+H2SO4=FeSO4+H2↑中的还原剂是。20. 美国正在实验助推火箭无损回收技术:火箭将飞船推送至一定高度;箭船分离,火箭停止喷火、落向地面;接近地面时,火箭再次消耗燃料、向下喷火,并以2m/s的速度匀速下降,如图所示。匀速下降时,火箭的动能(变小/不变/变大),重力势能(变小/不变/变大)。
18. 分类学习是化学学习中常用的方法,通过按一定标准分类研究,往往可以收到事半功倍的效果。仅含碳和氢两种元素的有机物称为烃,如烷烃、烯烃、炔烃等.烷烃中最简单的是甲烷(CH4),其余随碳原子数的增加,依次为乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等。如果烷烃中的碳原子数为n,则烷烃的化学式可以用通式表示。它们在氧气中完全燃烧的产物都是二氧化碳和水,试写出甲烷在空气中充分燃烧的化学方程式:。19. 分析、归纳、总结是学习科学的有效方法。在C+2CuO 高温 2Cu+CO2↑与CO+CuO △ Cu+CO2两个反应中,C和CO都是将CuO还原为Cu的物质,故在该反应中作还原剂。(1)、上述两个反应中还原剂的化合价变化规律:;(2)、根据你的规律,判断反应Fe+H2SO4=FeSO4+H2↑中的还原剂是。20. 美国正在实验助推火箭无损回收技术:火箭将飞船推送至一定高度;箭船分离,火箭停止喷火、落向地面;接近地面时,火箭再次消耗燃料、向下喷火,并以2m/s的速度匀速下降,如图所示。匀速下降时,火箭的动能(变小/不变/变大),重力势能(变小/不变/变大)。 21. 铝是生活中常见的金属。(1)、金属铝常用做导线是利用它的性;(2)、金属铝表面常有一层致密的氧化膜,氧化膜主要成分是(填名称或化学式);(3)、资料显示:铝与氢氧化钠和水反应生成偏铝酸钠(NaAlO2)和氢气;用56.25g含杂质4%的铝片(杂质对产生氢气的质量无影响)与足量的氢氧化钠和水充分反应,生成氢气的质量为g。22. 向硝酸银、硝酸铜和硝酸镁的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀盐酸,无明显现象,则滤液中一定含有的金属离子是什么? , 写出上述过程中一定发生反应的化学方程式。23. 鉴别失去标签的五瓶溶液:稀盐酸、稀硫酸、NaOH溶液、CuSO4溶液和BaCl2溶液。(1)、根据溶液颜色即可确定CuSO4溶液。取少量四种无色溶液分别放入四支试管中,再分别滴加CuSO4溶液,可鉴别出NaOH溶液和BaCl2溶液,鉴别出NaOH溶液的现象是;(2)、另取少量剩余的两种溶液分别放入两支试管中,再分别滴加BaCl2溶液,其中一支试管内产生白色沉淀,该反应可用化学方程式表示为 , 至此,五瓶溶液已全部鉴别出来;(3)、实验结束后,将所有试管中的物质充分混合,过滤除去沉淀,得到无色滤液;取少量无色滤液滴加Na2SO4溶液,无明显现象,另取少量无色滤液分别与下列物质混合时,一定无明显现象的是_______。A、酚酞溶液 B、Mg C、CuO D、Ba(OH)2溶液 E、AgNO3溶液24. 课外活动中,小红将稀盐酸加入盛有澄清石灰水的试管中,无明显现象;小强将稀盐酸加入盛有K2CO3溶液的试管中,有气体生成。反应结束后,两同学把废液倒入同一废液缸中,观察到废液缸中产生少量的气泡,最终有白色沉淀生成。请回答以下问题:(1)、废液缸中最终生成的白色沉淀是;(2)、通过分析废液缸中的现象,你认为小红实验后的废液中一定含有的溶质是。
21. 铝是生活中常见的金属。(1)、金属铝常用做导线是利用它的性;(2)、金属铝表面常有一层致密的氧化膜,氧化膜主要成分是(填名称或化学式);(3)、资料显示:铝与氢氧化钠和水反应生成偏铝酸钠(NaAlO2)和氢气;用56.25g含杂质4%的铝片(杂质对产生氢气的质量无影响)与足量的氢氧化钠和水充分反应,生成氢气的质量为g。22. 向硝酸银、硝酸铜和硝酸镁的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴加稀盐酸,无明显现象,则滤液中一定含有的金属离子是什么? , 写出上述过程中一定发生反应的化学方程式。23. 鉴别失去标签的五瓶溶液:稀盐酸、稀硫酸、NaOH溶液、CuSO4溶液和BaCl2溶液。(1)、根据溶液颜色即可确定CuSO4溶液。取少量四种无色溶液分别放入四支试管中,再分别滴加CuSO4溶液,可鉴别出NaOH溶液和BaCl2溶液,鉴别出NaOH溶液的现象是;(2)、另取少量剩余的两种溶液分别放入两支试管中,再分别滴加BaCl2溶液,其中一支试管内产生白色沉淀,该反应可用化学方程式表示为 , 至此,五瓶溶液已全部鉴别出来;(3)、实验结束后,将所有试管中的物质充分混合,过滤除去沉淀,得到无色滤液;取少量无色滤液滴加Na2SO4溶液,无明显现象,另取少量无色滤液分别与下列物质混合时,一定无明显现象的是_______。A、酚酞溶液 B、Mg C、CuO D、Ba(OH)2溶液 E、AgNO3溶液24. 课外活动中,小红将稀盐酸加入盛有澄清石灰水的试管中,无明显现象;小强将稀盐酸加入盛有K2CO3溶液的试管中,有气体生成。反应结束后,两同学把废液倒入同一废液缸中,观察到废液缸中产生少量的气泡,最终有白色沉淀生成。请回答以下问题:(1)、废液缸中最终生成的白色沉淀是;(2)、通过分析废液缸中的现象,你认为小红实验后的废液中一定含有的溶质是。三、实验探究题
-
25. 将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图。某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:
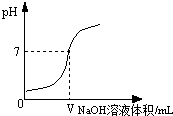 (1)、【猜想假设】
(1)、【猜想假设】猜想Ⅰ:pH增大是因为;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式;
(2)、【实验探究】为验证猜想Ⅱ,请你帮助该小组完成下列实验.(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
①向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7;
②向2mL0.4%的盐酸中加入VmL , 用pH计测得混合液的pH7(填“>”、“=”或“<”);综合①和②证明猜想Ⅱ成立。
26. 小明在学习金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气,他想镁紧排在钠后面,它是否也能与水反应呢?【提出问题】镁是否能与水反应?
【实验探究】在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂。实验过程和现象如图:

【反思与总结】
(1)、小明得出的实验结论是;(2)、小明发现B试管放置在空气中一会儿,溶液的红色会褪色,这说明溶液的碱性减弱了,于是他大胆作出了一个猜想并设计了验证方案:猜想
验证方案
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性减弱
将褪色后的溶液 , 如果溶液变红,说明小明的猜想正确
小明通过实验证明了自己的猜想是正确的。
(3)、一段时间后,小明观察到镁条在热水中无现象,但当他想到实验室制取二氧化碳不能用稀硫酸与大理石反应时,便有了解释,他的解释是。27. 2015年在苏州举行的第53届世乒赛中首次使用了“40+”新球,新球与“40”旧球如图甲所示.
小科想比较两种球的弹性大小,做了如下实验:将两球从相同高度由静止同时释放,比较两球落到同一桌面上弹起的高度得出弹性大小,发现很难比较两球弹起的高度,继续观察,两球在桌面上反复弹跳,发现新球停止弹跳时,旧球还在弹跳,如图乙所示,多次实验结果相同,说明旧球的弹性比新球好。
(1)、乒乓球下落过程中重力势能逐渐;(2)、该实验体现了转换的思想,将比较球的弹性分别转换为比较弹起的高度和。28. 在老师指导下,小科做了如下实验:点燃燃烧匙上的钠,迅速伸入盛有CO2的集气瓶中,盖上玻片,钠继续燃烧。反应结束后发现:集气瓶内壁附着黑色小颗粒,燃烧匙上粘附着灰白色固体。小科获知灰白色固体中的黑色固体成分是碳,但不清楚其中的白色固体成分是什么,于是进行了如下探究:【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;
假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氯化钠和碳酸钠的混合物。
【进行实验】
步骤1:取燃烧匙上灰白色固体于烧杯中,加入适量的水充分溶解,过滤,得到滤液;
步骤2:取少量步骤1中的滤液与试管中,滴加2滴酚酞试液,溶液变成红色。结论:白色固体的成分是氧化钠。
(1)、有同学认为通过该实验得出的结论不正确,其理由是。(2)、步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,结论是。(3)、步骤4:取少量步骤1的滤液于试管中,加入过量的氯化钙溶液,出现白色沉淀,然后过滤,向所得滤液中滴加酚酞试液,无明显现象,则假设成立。29. 铜跟浓硫酸的反应原理是:Cu + 2H2SO4(浓) CuSO4+ SO2↑+2H2O。某小组同学用下图所示装置制取硫酸铜。请回答以下问题: (1)、图中B装置用来收集SO2(已知SO2的密度大于CO2 的密度),但未将导管画全,请在答题纸上将B装置中的导管补画完整。(2)、图中C装置的作用是防止氢氧化钠溶液倒吸入B瓶中,装置D的作用是;(3)、充分反映后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验。
(1)、图中B装置用来收集SO2(已知SO2的密度大于CO2 的密度),但未将导管画全,请在答题纸上将B装置中的导管补画完整。(2)、图中C装置的作用是防止氢氧化钠溶液倒吸入B瓶中,装置D的作用是;(3)、充分反映后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验。实验1:用pH试纸测试滤液 pH,其pH约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填“实验1”或“实验2”)
(4)、以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有(答出两点即可。)四、解答题
-
30. 某工厂化验室常用10%的氢氧化钠溶液测定工业废水中硫酸的含量。(1)、若配制10%的氢氧化钠溶液200g,需称取NaOH的质量是g;(2)、取该氢氧化钠溶液40g恰好能将100g废水中的H2SO4中和,求废水中硫酸的质量分数(写出计算过程)。31. 实验室有一瓶长期存放的固体氢氧化钠,由于保管不当已经变质。某兴趣小组的同学欲通过实验测定其变质的情况。实验过程如下,取样品25g放入烧杯中,向其中加入280g过量的稀盐酸,得到296.2g溶液。试计算25g样品中碳酸钠的质量。32. 某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表格(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。
实验次数
加入稀盐酸的质量/g
剩余固体的质量/g
1
20
15
2
20
10
3
20
6.8
4
20
n
根据实验数据计算:
(1)、表中n的数值为;(2)、样品中碳酸钙的质量分数是;(3)、求盐酸中溶质的质量分数。33. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。(1)、小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是。 (2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。34. 小球在没有空气阻力的情况下,沿无摩擦轨道运动。
(2)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。34. 小球在没有空气阻力的情况下,沿无摩擦轨道运动。 (1)、如图1所示,小球从A点静止释放,小球到达C点时速度是否为零?;(2)、将轨道BC段改为水平,如图2所示,小球仍从A点静止释放,小球经过M点时的机械能大于、小于还是等于其在A点的机械能?。以小球经过M点时为计时起点,大致画出小球在MN段运动的速度-时间图线。
(1)、如图1所示,小球从A点静止释放,小球到达C点时速度是否为零?;(2)、将轨道BC段改为水平,如图2所示,小球仍从A点静止释放,小球经过M点时的机械能大于、小于还是等于其在A点的机械能?。以小球经过M点时为计时起点,大致画出小球在MN段运动的速度-时间图线。 35. 已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解。现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3 , 某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案。
35. 已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解。现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3 , 某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案。方案一:样品 测定生成CO2的质量。
方案二:

具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。
(1)、本实验采用如图所示的装置,C中盛放的物质是。 (2)、若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,(填“能”或“不能”)准确测定样品中NaHCO3的质量分数。(3)、实验时需要重复“加热、冷却、称量”操作多次,其目的是。(4)、根据题意,计算样品中NaHCO3的质量分数,写出计算过程。(已知:2NaHCO3 Na2CO3+H2O+CO2↑)36. 资科一:原煤中含有硫,燃烧时生成的SO2会污染空气;
(2)、若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,(填“能”或“不能”)准确测定样品中NaHCO3的质量分数。(3)、实验时需要重复“加热、冷却、称量”操作多次,其目的是。(4)、根据题意,计算样品中NaHCO3的质量分数,写出计算过程。(已知:2NaHCO3 Na2CO3+H2O+CO2↑)36. 资科一:原煤中含有硫,燃烧时生成的SO2会污染空气;资料二:测量SO2含量的反应原理为SO2+2H2O+I2=H2SO4+2HI,
资料三:加了生石灰的原煤燃烧时可减少SO2排放,反应原理为2CaO+2SO2+O2=2CaSO4。
请回答:
(1)、原煤燃烧产生的SO2在雨、雪降落过程中会形成 , 它能腐蚀建筑物、使土壤酸化等;(2)、取用原煤燃烧产生的工业废气样品1米3 , 缓缓通过含碘(I2)1.27毫克的碘溶液,刚好完全反应。则该工业废气中SO2的含量为毫克/米3(假设工业废气中的其它物质不与碘反应)(3)、若该工业废气中含有128克SO2 , 要除去这些SO2 , 理论上需在产生该工业废气的原煤中加入含氧化钙80%的生石灰多少克(假设工业废气中的其它物质不与氧化钙反应)?