北京市门头沟区2021年高考化学一模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 长征五号遥五运载火箭搭载“嫦娥五号”探测器成功发射,并实现中国首次月球无人采样返回,下列关于“嫦娥五号”涉及的材料为金属材料的是( )
 A、探测器上天线接收器外壳材料—镁合金防腐镀层 B、发动机使用的包覆材料—碳纤维 C、光学望远镜使用的材料之一——碳化硅 D、在月球展示的国旗材料一高性能芳纶纤维材料2. 下列过程不涉及氧化还原反应的是( )A、电解熔融氯化钠制金属钠 B、用明矾净水 C、用氯气制漂白粉 D、粮食酿酒3. 下列化学用语书写正确的是( )A、用电子式表示NaCl的形成过程:
A、探测器上天线接收器外壳材料—镁合金防腐镀层 B、发动机使用的包覆材料—碳纤维 C、光学望远镜使用的材料之一——碳化硅 D、在月球展示的国旗材料一高性能芳纶纤维材料2. 下列过程不涉及氧化还原反应的是( )A、电解熔融氯化钠制金属钠 B、用明矾净水 C、用氯气制漂白粉 D、粮食酿酒3. 下列化学用语书写正确的是( )A、用电子式表示NaCl的形成过程: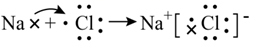 B、
B、 按照系统命名法的名称:2-乙基丙烷
C、中子数为18的氯原子:
D、 的球根模型:
按照系统命名法的名称:2-乙基丙烷
C、中子数为18的氯原子:
D、 的球根模型:  4. 已知:锶(38Sr)与镁元素同主族,与碘元素同周期。下列说法错误的是( )A、Sr位于元素周期表第五周期第ⅡA族 B、原子半径: C、相同条件下,Sr与水反应比Rb的更剧烈 D、碱性:5. 下列说法正确的是( )A、淀粉和纤维素属于糖类,且互为同分异构体 B、油脂的皂化反应得到高级脂肪酸和甘油 C、糖类、油脂和蛋白质均是天然高分子,都可发生水解反应 D、氨基酸是组成蛋白质的基本结构单元,分子中同时含有羧基和氨基6. 用 表示阿伏加德罗常数的值,下列说法正确的是( )A、22.4L氮气中含有7 个中子 B、 比 多 个质子 C、48g正丁烷和10g异丁烷的混合物中共价键数目为13 D、1L0.1mol/L醋酸钠溶液含有的 的数目为0.17. 下列解释事实的方程式正确的是( )A、 与稀盐酸反应: B、向 溶液中通入过量 : C、同浓度同体积 溶液与NaOH溶液混合: D、向AgCl悬浊液中滴加 溶液:8. 利用下列装置进行实验,能达到实验目的的是( )
4. 已知:锶(38Sr)与镁元素同主族,与碘元素同周期。下列说法错误的是( )A、Sr位于元素周期表第五周期第ⅡA族 B、原子半径: C、相同条件下,Sr与水反应比Rb的更剧烈 D、碱性:5. 下列说法正确的是( )A、淀粉和纤维素属于糖类,且互为同分异构体 B、油脂的皂化反应得到高级脂肪酸和甘油 C、糖类、油脂和蛋白质均是天然高分子,都可发生水解反应 D、氨基酸是组成蛋白质的基本结构单元,分子中同时含有羧基和氨基6. 用 表示阿伏加德罗常数的值,下列说法正确的是( )A、22.4L氮气中含有7 个中子 B、 比 多 个质子 C、48g正丁烷和10g异丁烷的混合物中共价键数目为13 D、1L0.1mol/L醋酸钠溶液含有的 的数目为0.17. 下列解释事实的方程式正确的是( )A、 与稀盐酸反应: B、向 溶液中通入过量 : C、同浓度同体积 溶液与NaOH溶液混合: D、向AgCl悬浊液中滴加 溶液:8. 利用下列装置进行实验,能达到实验目的的是( )A
B
C
D



分离乙醇与乙酸
模拟外加电流的阴极保护法
证明 有漂白性
证明乙炔可使溴水褪色
A、A B、B C、C D、D9. 乙醇水蒸气催化重整是一种清洁且可持续的制氢方法, 水滑石复合催化剂具有较好的催化活性,反应过程如图所示。(乙醇可用键线式表示为 )
) 
下列叙述错误的是( )
A、过程①和②中乙醇被吸附在Cu表面,被氧化为乙醛 B、过程③中存在极性键和非极性键的断裂 C、上述反应过程中复合催化剂的使用不仅提高反应速率,同时提高了平衡转化率 D、该过程的总反应:10. 常温下,0.1mol/L的一元酸HA溶液的 ,下列说法错误的是( )A、加水稀释10倍后, B、溶液中 电离出的 C、与0.1mol/L的NaA溶液等体积混合,溶液中 D、滴加NaOH溶液至 时,溶液中11. 高分子P是一种聚酰胺纤维,广泛用于各种刹车片,合成路线如图所示,下列说法正确的是( ) A、化合物A的核磁共振氢谱有三组峰 B、化合物B与乙二酸互为同系物 C、化合物C的分子式为 D、高分子P含有三种官能团12. 900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
A、化合物A的核磁共振氢谱有三组峰 B、化合物B与乙二酸互为同系物 C、化合物C的分子式为 D、高分子P含有三种官能团12. 900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: (g)
(g)  (g) ,经一段时间后达到平衡。
(g) ,经一段时间后达到平衡。
反应过程中测定的部分数据见表:
时间/
物质
0
10
20
30
40
n(乙苯)/
0.40
0.30
0.24
n(苯乙烯)/
0.00
0.10
0.20
0.20
下列说法正确的是( )
A、保持其他条件不变,向容器中充入不参与反应的水蒸气,则乙苯的转化率大于50% B、反应在前20min的平均速率为 C、保持其他条件不变,升高温度,平衡时,c(乙苯) ,则a<0 D、相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和 ,反应向正反应方向进行13. 某小组同学探究金属钠与不同盐溶液的反应,进行了如下实验。下列说法错误的是( )查阅资料:溶液中离子的浓度越大,离子所带的电荷数目越多,溶液的离子强度越大。
实验
序号
盐溶液
现象
①
溶液
与钠与水的反应类似,钠熔化成一个闪亮的小球,四处游动,速度较快,没有火花出现
②
2.0mol/LKCl溶液
反应比①剧烈,没有火花出现
③
溶液
反应比②剧烈,没有火花出现
④
溶液
反应瞬间即有黄色火花出现,并立即发生剧烈燃烧
A、由①②可知,随着KCl溶液浓度的增加,钠与KCl溶液的反应速率明显加快 B、实验③比②反应更加剧烈,一定是因为钠与碳酸根离子发生氧化还原反应 C、实验④中出现燃烧现象,是因为钠与水、与硝酸根离子发生了氧化还原反应,导致反应放出大量的热,达到了钠的着火点 D、推测若采用 溶液进行上述实验,也会出现钠的燃烧现象14. 我国科学家硏制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述错误的是( )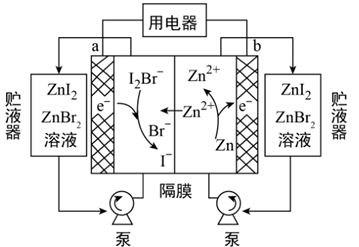 A、充电时,a电极接外电源正极 B、放电时,b电极发生氧化反应 C、充电时,阳极反应为 D、放电时,每消耗0.65g锌,溶液中离子总数增加
A、充电时,a电极接外电源正极 B、放电时,b电极发生氧化反应 C、充电时,阳极反应为 D、放电时,每消耗0.65g锌,溶液中离子总数增加二、非选择题
-
15. 全球大气 浓度升高对人类生活产生了影响, 的捕集和资源化利用成为硏究热点。(1)、 能引起海水酸化,原理为 , 因此 过量排放对海洋生态系统会造成严重影响。(2)、捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___________。A、 B、CaO C、 D、(3)、 甲烷化是实现其资源化利用的有效方式之一、
Ⅰ.热化学转化法:工业上常用 催化加氢合成 。
已知:①
②
③
反应 的 kJ/mol。
在该工业生产中,选用了高活性的Ni基催化剂,并且在低温下进行,其目的是:。
Ⅱ.电化学转化法:多晶Cu可高效催化 甲烷化,电解 制备 的原理示意图如下。
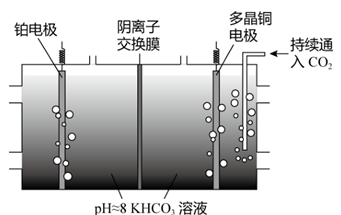
①多晶铜连接电源的极。(填“正”或“负”)
②阳极氧化产物只有 ,电解时实际生成 的总量小于由 理论计算所得 的量,结合电极反应式解释原因:。
16. 有机化合物K是某药物的合成中间体,其合成路线如下: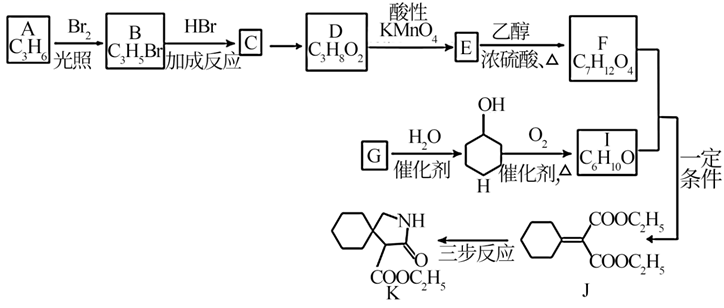 已知:① (R表示烃基);
已知:① (R表示烃基);②R-NH2+

 +C2H5OH(R代表烃基, 代表烃基或氢原子)
+C2H5OH(R代表烃基, 代表烃基或氢原子)请回答下列问题:
(1)、烯烃A的结构简式是。(2)、B中官能团的名称是。(3)、D→E的反应类型是。(4)、E→F的化学方程式是。(5)、下列说法正确的是___________。A、A存在顺反异构 B、C→D的试剂及反应条件为NaOH水溶液、加热 C、若G为烃,G可发生聚合反应 D、H可以与Na、NaOH溶液发生反应(6)、J经三步反应合成K,写出中间产物1及中间产物2的结构简式。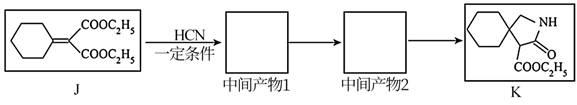 17. 过氧化氢 常被称为绿色氧化剂。(1)、 电子式是。(2)、为分析 对 分解反应的催化效果,某同学做了以下实验。
17. 过氧化氢 常被称为绿色氧化剂。(1)、 电子式是。(2)、为分析 对 分解反应的催化效果,某同学做了以下实验。实验ⅰ.向 溶液中滴加5滴 溶液,较快产生无色无味气体。
实验ⅱ.向 溶液中滴加5滴 溶液,无气体产生。
由此推断 对 分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b. 。实验ⅱ的目的是:。
(3)、硏究表明:过氧化氢溶液中 的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图1所示。

已知: ,
①一定条件下,相同时间内 分解率随溶液 增大而增大的原因是:。
②相同 下,过氧化氢浓度越大分解速率越快,但是相同时间内 分解率反而降低,分析其原因。
(4)、 常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。①酸性条件下 腐蚀金属铜的离子方程式为。
②图2是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因。
 18. 亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。(1)、实验一:制备
18. 亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。(1)、实验一:制备该小组查阅资料: ,
制备装置如图所示(夹持装置略去):

写出A中发生反应的离子方程式。
(2)、甲同学检查完装置气密性良好后进行实验,发现制得的 中混有较多的 杂质。为了提高了 的纯度,可采取的改进措施是。(3)、装置D可将剩余的NO氧化成 ,发生反应的离子方程式为。(4)、实验二:以亚硝酸钠溶液为硏究对象,探究 的性质。实验
实验编号
试剂
现象
滴管
试管

①
1%酚酞溶液
溶液
溶液变为浅红色,微热后红色加深
②
溶液
溶液
开始无明显变化,向溶液中滴加稀硫酸后紫色褪去
③
溶液
溶液
无明显变化
④
溶液
溶液
溶液变黄后迅速变为棕色,再滴加KSCN溶液变红
资料: 在溶液中呈棕色。
结合化学用语解释实验①“微热后红色加深”的原因。
(5)、解释实验④中“溶液变黄后迅速变为棕色”的原因(用离子方程式表示)。(6)、取一支试管,加入少量实验④中的棕色溶液,加热,有无色气体逸出,在近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因。19. 在钢中加入一定量的钒,就能使钢的硬度、耐腐蚀性大增。工业上以富钒炉渣(主要成分为 、 和 等)为原料提取五氧化二钒的工艺流程如下: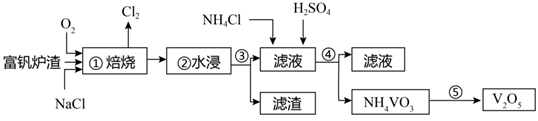 (1)、在第—步操作焙烧过程中 转化为可溶性 ,该反应的化学方程式为。(2)、焙烧炉中可用 代替NaCl与富钒炉渣焙烧制得偏钒酸钠。用 代替NaCl的优点是。(3)、以上流程中应用过滤操作的有 , 在第三步操作后加入氯化铵得到偏钒酸铵 ,为使钒元素的沉降率达到98%,要加入较多的 ,从平衡角度分析原因。(4)、产品纯度测定:将mg产品溶于足量稀硫酸配成 溶液。取20.00mL该溶液于锥形瓶中,用 标准溶液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准溶液的体积为20.00mL。
(1)、在第—步操作焙烧过程中 转化为可溶性 ,该反应的化学方程式为。(2)、焙烧炉中可用 代替NaCl与富钒炉渣焙烧制得偏钒酸钠。用 代替NaCl的优点是。(3)、以上流程中应用过滤操作的有 , 在第三步操作后加入氯化铵得到偏钒酸铵 ,为使钒元素的沉降率达到98%,要加入较多的 ,从平衡角度分析原因。(4)、产品纯度测定:将mg产品溶于足量稀硫酸配成 溶液。取20.00mL该溶液于锥形瓶中,用 标准溶液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准溶液的体积为20.00mL。资料:钒的盐类的颜色五光十色,有绿的、红的、黑的、黄的,绿的碧如翡翠,黑的犹如浓墨。这些色彩缤纷的钒的化合物,常被制成鲜艳的颜料。如: 溶液为黄色, 溶液为蓝色,而五氧化二钒则是红色的。
①完成下列滴定过程的离子方程式。 ,
②该滴定实验不需要另外加入指示剂,达到滴定终点的现象是。
③产品的纯度为。(用质量分数表示)已知相对分子质量: ; 。