北京市丰台区2021年高考化学二模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 化学可使生活更美好。下列说法错误的是( )A、食盐可用作调味剂,也可作食品防腐剂 B、包装用材料聚乙烯和聚氯乙烯都属于烃 C、疫苗一般应冷藏存放,目的是避免蛋白质变性 D、利用油脂的皂化反应可制得高级脂肪酸盐和甘油2. 下列氧化还原反应中,水作氧化剂的是( )A、C+H2O CO+H2 B、2Na2O2+2H2O=4NaOH+O2↑ C、2F2+2H2O=4HF+O2 D、3NO2+H2O=2HNO3+NO3. 不能作为判断硫、氯两种元素非金属性强弱的依据是( )A、单质氧化性的强弱 B、单质沸点的高低 C、单质与氢气化合的难易 D、最高价氧化物对应的水化物酸性的强弱4. 下列说法错误的是( )A、丁达尔效应可鉴别胶体与溶液 B、红外光谱可区分乙醇与二甲醚 C、碘水可检验淀粉是否发生水解 D、乙醇易溶于水是因为其分子与水分子间形成氢键5. 下列化学用语正确的是( )A、氢氧化铝电离:Al(OH)3=Al3++3OH- B、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- C、氯气与石灰乳反应制漂白粉:2Cl2+Ca2++2OH-=2Cl-+Ca(ClO)2+2H2O D、向Mg(OH)2悬浊液中滴酚酞后溶液变红:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)6. 淀粉在人体内被转化成葡萄糖为机体提供能量,是重要的食品工业原料。

下列说法错误的是( )
A、淀粉属于天然有机高分子 B、③的反应为人体提供能量 C、④的反应是水解反应 D、麦芽糖与蔗糖互为同分异构体7. 下列实验装置错误的是( )A.制取并收集乙烯气体
B.制取并收集氨气


C.制取乙酸乙酯
D.铁粉与水蒸气反应

 A、A B、B C、C D、D8. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2L0.5mol/LCH3COOH溶液中含有H+的数目为NA B、23gNa与足量H2O反应完全后生成H2的体积为11.2L C、密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA D、物质的量相同的
A、A B、B C、C D、D8. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2L0.5mol/LCH3COOH溶液中含有H+的数目为NA B、23gNa与足量H2O反应完全后生成H2的体积为11.2L C、密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA D、物质的量相同的 和CH3CHO所含共价键数目相同
9. 在RH—10Fe的作用下,合成某有机化合物的催化机理如图所示。下列说法错误的是( )
和CH3CHO所含共价键数目相同
9. 在RH—10Fe的作用下,合成某有机化合物的催化机理如图所示。下列说法错误的是( )资料:
①RH—10Fe是常温下以溶剂萃取和溶胶凝胶法,利用Fe(NO3)3溶液和稻谷壳中提取的硅酸盐材料制得的Fe-Si催化剂。
②硅酸盐材料具有多孔状结构,热稳定性佳,可用作催化剂载体。
 A、催化剂具有选择性 B、硅酸盐材料可用作催化剂载体参与化学反应 C、RH—10Fe催化可提高反应物的平衡转化率,原子利用率达100% D、总反应式为:
A、催化剂具有选择性 B、硅酸盐材料可用作催化剂载体参与化学反应 C、RH—10Fe催化可提高反应物的平衡转化率,原子利用率达100% D、总反应式为: +H2O2
+H2O2  +H2O
10. 依据图示关系,下列说法错误的是( )
+H2O
10. 依据图示关系,下列说法错误的是( ) A、反应①是吸热反应 B、△H3=△H1+△H2 C、反应③是一个熵增的反应 D、数据表明:V2O5(s)的能量比V2O4(s)低,更稳定11. 甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),下列各组物质中不能实现如图所示关系转化的是( )
A、反应①是吸热反应 B、△H3=△H1+△H2 C、反应③是一个熵增的反应 D、数据表明:V2O5(s)的能量比V2O4(s)低,更稳定11. 甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),下列各组物质中不能实现如图所示关系转化的是( )选项
甲
乙
丙
丁
物质间的转化
A
CuO
CO2
CO
C

B
Fe
Fe(NO3)2
Fe(NO3)3
HNO3
C
AlCl3
Al(OH)3
NaAlO2
NH3·H2O
D
CO2
NaHCO3
Na2CO3
NaOH
A、A B、B C、C D、D12. 某温度下,反应2H2(g)+CO(g)⇌CH3OH(g)在密闭容器中达到平衡时,测得c(H2)=0.4mol/L,c(CO)=0.2mol/L,c(CH3OH)=0.3mol/L,相同温度下,按照下列4组初始浓度进行实验,反应能够正向进行的是( )选项
c(H2)/mol/L
c(CO)/mol/L
c(CH3OH)/mol/L
A
1.00
0.10
1.00
B
0.10
2.00
0.05
C
0.02
5.00
0.30
D
0.15
0.10
0.60
A、A B、B C、C D、D13. 下列图示与对应叙述相符的是( ) A、图1表示压强对可逆反应2A(g)+B(g)⇌3C(g)+D(s)的影响,乙的压强大 B、图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 C、图3表示在CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 D、图4表示常温下向20 mL0.1 mol/L氨水中滴加稀盐酸,c点溶液中c(NH )<c(Cl-)14. 某实验小组为研究黄铜(Cu—Zn合金)的抗腐蚀性能,进行了系列实验,结果如下:
A、图1表示压强对可逆反应2A(g)+B(g)⇌3C(g)+D(s)的影响,乙的压强大 B、图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 C、图3表示在CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 D、图4表示常温下向20 mL0.1 mol/L氨水中滴加稀盐酸,c点溶液中c(NH )<c(Cl-)14. 某实验小组为研究黄铜(Cu—Zn合金)的抗腐蚀性能,进行了系列实验,结果如下:实验
0~1h
1h
2h
1
6mol/L盐酸
无气泡产生
2
3mol/L硫酸
无气泡产生
黄铜表面出现少量小气泡,反应缓慢
黄铜表面小气泡数量增加不明显,反应缓慢
3
6mol/L硝酸
2min时出现较多气泡,反应迅速进行;10min时出现明显的红棕色气体
溶液变为蓝色,反应持续进行,但不剧烈
溶液变为蓝色,反应持续进行,较为缓慢
4
2mol/L硝酸
黄铜表面出现少量小气泡,反应缓慢
溶液出现淡蓝色,反应缓慢
溶液出现淡蓝色,反应缓慢
4
浓硝酸
反应物接触后迅速反应,反应剧烈,产生大量红棕色气体,溶液变为深蓝色
依据上述实验,所得结论错误的是( )
A、实验1、2、3中反应速率不同,与溶液中阴离子种类有关 B、可用稀硫酸溶解黄铜以测定铜的质量分数 C、硝酸与黄铜反应的速率随硝酸浓度增大而加快 D、黄铜在稀硫酸中有较强的抗腐蚀性能,说明其结构与简单Cu—Zn混合物不同二、非选择题
-
15. 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。(1)、Ⅰ.银的冶炼及性质
热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为。
(2)、电解精炼银的工作原理如图所示,(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为。 (3)、Ⅱ.银的化合物的性质
(3)、Ⅱ.银的化合物的性质在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__。
(4)、在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为。(5)、纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式。16. M是有机合成的重要中间体,可用来合成广谱抗流感药物法匹拉韦(Favipiravir),其合成路线如图:
已知:i.J的核磁共振氢谱峰面积比为6:4:2:1。
ii.R1—CHO+R2—NH2 R1—CH=N—R2+H2O。
(1)、A是含碳92.3%的烃,写出实验室制取A的化学方程式。(2)、检验E中官能团所用的试剂是。(3)、B→C的反应类型是。(4)、写出C+K→M的化学方程式。(5)、下列说法正确的是。a.D比丙醇的沸点高
b.F与乙酸互为同系物
c.J可以发生水解反应生成氨基酸
d.K可以与盐酸反应生成相应的盐
(6)、写出符合下列条件G的同分异构体的结构简式。①可以发生银镜反应和水解反应
②核磁共振氢谱有三组峰
17. 镀镍废件是一种宝贵的可再生资源,可用于制备重要的化工原料NiSO4。将镀镍废件处理后得到废液(含大量的H+、SO 、Ni2+以及少量的Zn2+、Cu2+、Fe2+、Fe3+等),采用如图工艺流程回收其中的镍制备NiSO4晶体。
资料:
P2O4为磷酸二异辛酯(可用HA表示),不溶于水,是一种弱酸性萃取剂。其酸根离子(A-)可与某些金属离子发生反应。
(1)、写出H2O2的电子式。(2)、加入H2O2溶液发生反应的离子方程式为。(3)、加石灰乳的作用是。 (4)、在萃取过程中,若溶液酸度过高,会导致萃取效率变低,其原因是。(5)、在结晶过程中,需要加浓硫酸调pH至2~4,再进行 , 过滤出的固体洗涤、干燥,得NiSO4晶体。
(4)、在萃取过程中,若溶液酸度过高,会导致萃取效率变低,其原因是。(5)、在结晶过程中,需要加浓硫酸调pH至2~4,再进行 , 过滤出的固体洗涤、干燥,得NiSO4晶体。NiSO4在不同温度下的溶解度
温度/℃
20
30
40
60
80
90
100
溶解度/g
44.4
46.6
49.2
55.6
64.5
70.1
76.7
(6)、NiSO4在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式。18. 氯化亚铜(CuCl)是重要的化工原料,广泛用作有机合成催化剂。资料
①水溶液中存在平衡:2Cl-(aq)+CuCl(s) CuCl (aq)。
②CuCl是难溶于水的白色固体,在热水中迅速水解生成Cu2O。
③CuCl在潮湿的空气中易被氧化,生成的碱式盐为Cu2(OH)3Cl。
Ⅰ.实验室中用纯净的CuCl2固体可制备CuCl。取75gCuCl2固体于烧杯中,加入100mL0.2mol/L盐酸和水配成200mL溶液,然后在溶液中通入SO2气体。
(1)、结合化学用语解释加入盐酸的主要目的是。(2)、溶液中通入SO2气体后,发生反应的离子方程式为。(3)、Ⅱ.工业中,用初级铜矿粉(主要含Cu2S及少量Fe2O3、FeO等)为原料制备CuCl。流程如图:
“酸浸”中,加入稀H2SO4不宜过量太多的原因是__。
(4)、用化学用语解释,析出的CuCl晶体不能用水洗涤的原因是。(5)、合成过程中适宜的反应条件为。(6)、若要制99.5gCuCl,理论上至少需要含Cu2S50%的铜矿粉的质量为g。(7)、相同时间内,反应物在最佳配比条件下,温度对CuCl产率影响如图所示。溶液温度控制在58℃时,CuCl产率最大,随温度升高CuCl产率降低,其原因是。(答出2条即可) 19. 研究发现,NO在心脑血管调节、免疫调节等方面有着十分重要的作用,但NO无法直接作为药物使用。科学家发现NO 有着与NO相似的功效,可以用作药物。某研究小组对亚硝酸盐转化为NO的反应进行了研究。(1)、NO中N元素的化合价呈现正价,用原子结构解释原因为。(2)、为研究NO 的转化,甲同学完成了如下实验:
19. 研究发现,NO在心脑血管调节、免疫调节等方面有着十分重要的作用,但NO无法直接作为药物使用。科学家发现NO 有着与NO相似的功效,可以用作药物。某研究小组对亚硝酸盐转化为NO的反应进行了研究。(1)、NO中N元素的化合价呈现正价,用原子结构解释原因为。(2)、为研究NO 的转化,甲同学完成了如下实验:实验方案
实验现象

i.溶液先变黄色,迅速变为棕色
ii.将棕色溶液加热,颜色变浅,冷却
资料:FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0
在冷却后的溶液中滴加(填“试剂和现象”),说明有Fe3+生成。从而证明Fe2+可以还原NO 。
(3)、乙同学认为甲同学的实验方案不严谨,其理由是。并进一步利用下列实验装置进行实验,以验证甲同学的实验结论是正确的。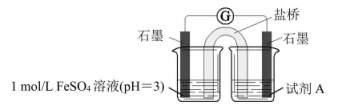
①右侧烧杯中试剂A是。
②实验证据是。
(4)、写出NaNO2溶液与FeSO4溶液反应的离子方程式。(5)、解释“棕色溶液加热,颜色变浅”的原因是。(6)、研究表明,亚硝酸盐能够被人体内含Fe2+等的还原性酶还原为NO,NO的生物学作用揭示着无机分子在医学领域中的重要作用,它与血红素铁具有很高的亲合力,以取代O2的位置。因此,亚硝酸盐作为药物使用时,必须严格控制剂量。若服用过量,可能会产生的影响是。