北京市房山区2021年高考化学一模试卷
试卷更新日期:2021-06-17 类型:高考模拟
一、单选题
-
1. 对文物和历史的研究,能够让我们领略到文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A
B
C
D




复原变形金属
补配玉器缺损
青铜器除锈见新
剥离丝绸残片
A、A B、B C、C D、D2. 下列化学用语错误的是( )A、HClO的结构式: B、乙烯的球棍模型: C、Cl的原子结构示意图:
C、Cl的原子结构示意图:  D、溴乙烷的官能团:-Br
3. 下列说法错误的是( )A、淀粉和葡萄糖互为同系物 B、氨基酸能与酸、碱反应生成盐 C、乙醛和乙酸可用NaHCO3溶液进行鉴别 D、氢键是一种分子间作用力4. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、7.8 g Na2O2中含有的离子数为0.3 NA B、1 mol NO2与水完全反应转移的电子数为NA C、标准状况下,22.4 L NH3含有的质子数为5NA D、1 L 0.1mol·L-1 NH4Cl溶液中含有的NH4+数为0.1NA5. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法错误的是( )A、质子数为31 B、原子半径比K的大 C、位于元素周期表第ⅢA族 D、 的碱性比 强6. 在 基催化剂表面, 还原合成 有以下两种途径,如图所示。下列说法错误的是( )
D、溴乙烷的官能团:-Br
3. 下列说法错误的是( )A、淀粉和葡萄糖互为同系物 B、氨基酸能与酸、碱反应生成盐 C、乙醛和乙酸可用NaHCO3溶液进行鉴别 D、氢键是一种分子间作用力4. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、7.8 g Na2O2中含有的离子数为0.3 NA B、1 mol NO2与水完全反应转移的电子数为NA C、标准状况下,22.4 L NH3含有的质子数为5NA D、1 L 0.1mol·L-1 NH4Cl溶液中含有的NH4+数为0.1NA5. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法错误的是( )A、质子数为31 B、原子半径比K的大 C、位于元素周期表第ⅢA族 D、 的碱性比 强6. 在 基催化剂表面, 还原合成 有以下两种途径,如图所示。下列说法错误的是( ) A、途径Ⅰ中 分子仅断裂 键 B、途径Ⅱ中 分子中仅有一个N原子生成 ,另一N原子不参与反应 C、两种途径的总反应式均 D、使用 基催化剂可以降低反应的活化能,从而提高化学反应速率7. 下列化学用语对事实的表述错误的是( )A、电解精炼铜的阴极反应: B、由Na和Cl形成离子键的过程:
A、途径Ⅰ中 分子仅断裂 键 B、途径Ⅱ中 分子中仅有一个N原子生成 ,另一N原子不参与反应 C、两种途径的总反应式均 D、使用 基催化剂可以降低反应的活化能,从而提高化学反应速率7. 下列化学用语对事实的表述错误的是( )A、电解精炼铜的阴极反应: B、由Na和Cl形成离子键的过程: C、常温时,0.1mol/L氨水的pH=11.1:
D、石灰水敞口存放,出现白色固体:
8. 线型PAA(
C、常温时,0.1mol/L氨水的pH=11.1:
D、石灰水敞口存放,出现白色固体:
8. 线型PAA( )具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如图所示,下列说法错误的是( )
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如图所示,下列说法错误的是( )  A、线型PAA的单体不存在顺反异构现象 B、形成网状结构的过程发生了缩聚反应 C、交联剂a的结构简式是
A、线型PAA的单体不存在顺反异构现象 B、形成网状结构的过程发生了缩聚反应 C、交联剂a的结构简式是 D、PAA的高吸水性与-COONa有关
9. 下列实验中的颜色变化,与氧化还原反应无关的是( )
D、PAA的高吸水性与-COONa有关
9. 下列实验中的颜色变化,与氧化还原反应无关的是( )A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
A、A B、B C、C D、D10. 下列实验装置不能达成实验目的的是( )A
B
C
D




实验室制取蒸馏水
实验室制取氨气
除去CO2中的少量HCl
收集NO2
A、A B、B C、C D、D11. 一种新型 水介质电池,为解决环境和能源问题提供了一种新途径,其工作示意图如图所示,下列说法错误的是( ) A、放电时,金属锌为负极 B、放电时,温室气体 被转化为储氢物质HCOOH C、充电时,电池总反应为 D、充电时,双极隔膜产生的 向右侧正极室移动12. 甲酸甲酯是重要的有机化工原料,制备反应为 ,相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比 均为1),测得CO的转化率随温度变化的曲线如图所示。下列说法中,错误的是( )
A、放电时,金属锌为负极 B、放电时,温室气体 被转化为储氢物质HCOOH C、充电时,电池总反应为 D、充电时,双极隔膜产生的 向右侧正极室移动12. 甲酸甲酯是重要的有机化工原料,制备反应为 ,相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比 均为1),测得CO的转化率随温度变化的曲线如图所示。下列说法中,错误的是( ) A、a点对应的CO的转化率与 的转化率相同 B、b点和e点的平衡常数: C、70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大 D、85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动13. HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,错误的是( )
A、a点对应的CO的转化率与 的转化率相同 B、b点和e点的平衡常数: C、70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大 D、85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动13. HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,错误的是( ) A、pH=9时,c(A-)=c(HA) B、x=0时,1<pH<7 C、x=5时,c(A-)=c(HA) D、x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L14. 苯酚与 溶液的显色反应原理可表示为Fe3++6
A、pH=9时,c(A-)=c(HA) B、x=0时,1<pH<7 C、x=5时,c(A-)=c(HA) D、x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L14. 苯酚与 溶液的显色反应原理可表示为Fe3++6
 +6H+ , 下列说法错误的是( )
+6H+ , 下列说法错误的是( )  A、苯酚的电离方程式是
A、苯酚的电离方程式是
 +H+
B、紫色物质的生成与 有关
C、向苯酚与 混合溶液中滴加盐酸,溶液颜色变浅
D、如图所示进行实验,可探究阴离种类对显色反应的影响
+H+
B、紫色物质的生成与 有关
C、向苯酚与 混合溶液中滴加盐酸,溶液颜色变浅
D、如图所示进行实验,可探究阴离种类对显色反应的影响
二、综合题
-
15. 二氧化碳的捕集与资源化利用是实现碳减排的重要途径。(1)、 的电子式是。(2)、下列物质理论上可以作为 捕集吸收剂的是。(填序号)
a.稀 b.氨水c. 溶液d. 溶液
(3)、工业上以 、 为原料生产尿素 ,该反应分为二步进行:第一步:
第二步:
①写出上述合成尿素的热化学方程式。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入 和 ,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。
(4)、 较稳定、能量低。为实现 的资源化利用,下列研究方向合理的是(填序号)。a.选择低能量的反应物和 反应获得高能量的生成物
b.利用电能、光能或热能活化 分子
c.选择高效的催化剂
16. 硫及其化合物在生产、生活中用途广泛。(1)、S在元素周期表中的位置。(2)、 是工业制备 的主要反应之一、①提高 平衡转化率,可采取的措施。
② ℃时,2L密闭容器中,充入 和 , 随时间的变化如表:
时间/s
0
1
2
3
4
5
……
2
1.4
1.0
0.65
0.4
0.4
……
℃时,该反应的化学平衡常数(K)的代数式是。
(3)、工业上用 溶液吸收烟气中的低浓度 ,形成吸收液后再采用阳离子膜电解法控制电压,电解吸收液可制成产品S和 。工作原理示意图如图1,阴极区和阳极区的pH随时间的变化关系如图2:
①阳极反应的电极反应物是。
②结合电极反应式,说明阴极区pH升高的原因。
17. 高纯氯化锰 在电子技术和精细化工领域有重要应用。一种由粗锰粉(含磷酸盐、硅酸盐、铁、铅等)制备高纯氯化锰的工艺流程如下(部分操作和条件略)。Ⅰ.将粗锰粉加入盐酸中充分反应,再加入NaOH溶液调节pH=6,过滤;
Ⅱ.向Ⅰ所得滤液中加入 酸性溶液,充分反应后加入 调节 ,过滤;
Ⅲ.向Ⅱ所得滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
Ⅳ.浓缩、结晶、分离、干燥,得到产品
(1)、氯化锰中锰元素的化合价是。(2)、步骤Ⅰ中去除了磷酸盐和硅酸盐,且对磷酸盐的去除效果比硅酸盐好,这与酸性 有关。从原子结构角度解释酸性 原因:。(3)、步骤Ⅰ所得滤液中的金属离子主要含有 、 和 等,且 不被 氧化。已知:生成氢氧化物沉淀的pH
开始沉淀时
6.5
1.5
8.1
6.5
完全沉淀时
8.3
2.8
10.1
8.5
注:金属离子的起始浓度为0.1mol/L
①结合表中数据,解释步骤Ⅱ中加入 酸性溶液的目的:。
②配平加入 后发生反应的离子方程式: ,
(4)、步骤Ⅲ的目的是去除 : 。推测溶解度:PbSMnS(填“>”、“<”或“=”)。(5)、已知:氯化锰的溶解度随温度的变化如图。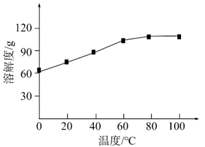
步骤Ⅲ所得滤液中仍含有少量易溶杂质,补充步骤Ⅳ浓缩、结晶的操作:将滤液 , 析出晶体后过滤。重复操作2~3次,收集晶体。
18. 有机物Q是合成抗肿瘤、抗凝血药的中间体,其合成路线如下。
已知:Ⅰ.
 +
+  →
→ 
Ⅱ.
 (1)、A的分子式为 ,A中所含官能团的名称是。(2)、A→B的反应方程式是。(3)、D→X的反应方程式是。(4)、物质a是分子式为 的酯类物质,核磁共振氢谱有两种吸收峰,其结构简式是。(5)、Y的结构简式是 ,反应ⅰ的反应类型是。(6)、生成Q的“三步反应”,依次为“加成反应→消去反应→取代反应”,写出中间产物的结构简式。
(1)、A的分子式为 ,A中所含官能团的名称是。(2)、A→B的反应方程式是。(3)、D→X的反应方程式是。(4)、物质a是分子式为 的酯类物质,核磁共振氢谱有两种吸收峰,其结构简式是。(5)、Y的结构简式是 ,反应ⅰ的反应类型是。(6)、生成Q的“三步反应”,依次为“加成反应→消去反应→取代反应”,写出中间产物的结构简式。 19. 化学变化是有条件的。某小组同学探究 与金属阳离子的氧化还原反应,实验过程如下。
19. 化学变化是有条件的。某小组同学探究 与金属阳离子的氧化还原反应,实验过程如下。已知:同浓度的稀溶液中氧化性: 。
实验
现象

编号
溶液X
Ⅰ
和 ,其中 ,
1小时内溶液颜色始终保持无色
Ⅱ
,
溶液黄色立即加深,30s后溶液变为褐色,无浑浊
Ⅲ
,
5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有 ),固体为白色(CuI)
Ⅳ
迅速变浑浊,离心分离后上层溶液为无色(经检测无 ),固体为黄色(AgI)
(1)、实验Ⅰ的目的是。(2)、实验Ⅱ中“黄色立即加深”初步判断有 生成,选择(填试剂)进一步证实生成了 。该条件下氧化性: (填“>”、“<”)。(3)、实验Ⅲ中 与 反应的离子方程式是 , 甲同学得出氧化性: 。(4)、乙同学认为甲同学的结论不合理,推测实验Ⅲ中 的生成,与CuI沉淀有关,不能确定氧化性: ,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。为了进一步判断 和 的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入 ,发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性: (填“>”、“<”)。 (5)、该小组同学进一步分析认为,实验Ⅳ没有发生 的原因是: 和 生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅲ发生氧化还原反应的原因是。
(5)、该小组同学进一步分析认为,实验Ⅳ没有发生 的原因是: 和 生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅲ发生氧化还原反应的原因是。实验结论:在反应体系中,各物质的浓度对氧化还原反应的发生有一定的影响。