2021高考真题汇编-反应速率、化学平衡
试卷更新日期:2021-06-17 类型:二轮复习
一、单选题
-
1. 常温下,用 的盐酸分别滴定20.00mL浓度均为 三种一元弱酸的钠盐 溶液,滴定曲线如图所示。下列判断错误的是( )
 A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:2. 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:2. 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是( )
A、该过程的总反应为 B、 浓度过大或者过小,均导致反应速率降低 C、该催化循环中 元素的化合价发生了变化 D、该过程的总反应速率由Ⅱ→Ⅲ步骤决定3. 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是( ) A、0~30min时间段内,Y的平均反应速率为6.67×10-8mol•L-1•min-1 B、反应开始后,体系中Y和Z的浓度之比保持不变 C、如果反应能进行到底,反应结束时62.5%的M转化为Z D、反应①的活化能比反应②的活化能大4. 下列方案设计、现象和结论都正确的是( )
A、0~30min时间段内,Y的平均反应速率为6.67×10-8mol•L-1•min-1 B、反应开始后,体系中Y和Z的浓度之比保持不变 C、如果反应能进行到底,反应结束时62.5%的M转化为Z D、反应①的活化能比反应②的活化能大4. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
检验某无色溶液中是否含有NO
取少量该溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液
若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO
B
探究KI与FeCl3反应的限度
取5 mL 0.1 mol·L-1KI溶液于试管中,加入1 mL 0.1 mol·L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液
若溶液变血红色,则KI与FeCl3的反应有一定限度
C
判断某卤代烃中的卤素
取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,再滴加AgNO3溶液
若产生的沉淀为白色,则该卤代烃中含有氯元素
D
探究蔗糖在酸性水溶液中的稳定性
取2mL20%的蔗糖溶液于试管中,加入适量稀 H2SO4后水浴加热5 min;再加入适量新制Cu(OH)2悬浊液并加热
若没有生成砖红色沉淀 ,则蔗糖在酸性水溶液中稳定
A、A B、B C、C D、D5. 实验测得10 mL 0.50 mol·L-1NH4Cl溶液、10 mL 0.50mol·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法错误的是( )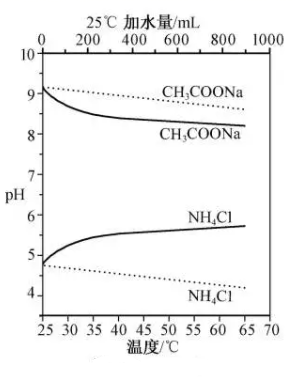 A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )6. 取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
A、图中实线表示pH随加水量的变化,虚线表示pH随温度的变化' B、将NH4Cl溶液加水稀释至浓度 mol·L-1 , 溶液pH变化值小于lgx C、随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小 D、25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH )6. 取50 mL过氧化氢水溶液,在少量I- 存在下分解:2H2O2=2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:t/min
0
20
40
60
80
c/(mol·L-1)
0.80
0.40
0.20
0.10
0.050
下列说法错误的是( )
A、反应20min时,测得O2体积为224mL(标准状况) B、20~40min,消耗H2O2的平均速率为0.010mol·L-1·min-1 C、第30min时的瞬时速率小于第50min时的瞬时速率 D、H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解7. 在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1 , N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是( )A、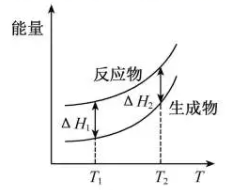 B、
B、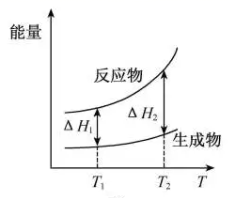 C、
C、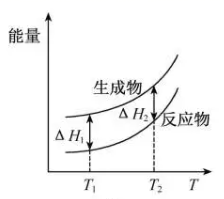 D、
D、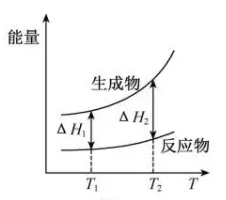
二、多选题
-
8. 已知: ,向一恒温恒容的密闭容器中充入 和 发生反应, 时达到平衡状态I,在 时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
 A、容器内压强不变,表明反应达到平衡 B、 时改变的条件:向容器中加入C C、平衡时A的体积分数 : D、平衡常数K:
A、容器内压强不变,表明反应达到平衡 B、 时改变的条件:向容器中加入C C、平衡时A的体积分数 : D、平衡常数K:三、综合题
-
9. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1)、反应 ;(2)、已知该反应的 ,在下列哪些温度下反应能自发进行?_______(填标号)A、25℃ B、125℃ C、225℃ D、325℃(3)、某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。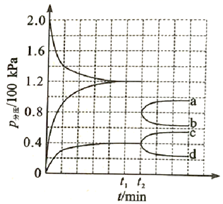
①若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应 , ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。
 (4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。
(4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。KOH溶液KOH溶液
10. 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:(1)、历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现。该元素是.(2)、氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2 , 376.8℃时平衡常数K‘p=1.0x104Pa2。在一硬质玻璃烧瓶中加入过量BaPtCl6 , 抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8℃,碘蒸气初始压强为20.0kPa.376.8℃平衡时,测得烧瓶中压强为32.5kPa,则PICl=kPa,反应2ICl(g)=Cl2(g)+I2(g)的平衡常数K=(列出计算式即可).(3)、McMorris 测定和计算了在136-180℃范围内下列反应的平衡常数KP :2NO(g)+2ICl(g) 2NOCl(g)+I2(g) KP1
2NOCl(g) 2NO(g)+Cl2(g) KP2
得到lgKP1 和lgKP2 均为线性关系,如下图所示:

①由图可知,NOCl分解为NO和Cl2反应的ΔH0(填“大于”或“小于”).
②反应2ICl(g)=Cl2(g)+I2(g)的K=(用KP1、KP2表示):该反应的ΔH0(填“大于”或“小于”),写出推理过程.
(4)、Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:NOCl+hv→NOC*
NOCl+NOCl*→2NO+Cl2
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收mol的光子。
11. “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:(1)、电解饱和食盐水制取氯气的化学方程式是。(2)、下列说法错误的是______。A、可采用碱石灰干燥氯气 B、可通过排饱和食盐水法收集氯气 C、常温下,可通过加压使氯气液化而储存于钢瓶中 D、工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸(3)、在一定温度下,氯气溶于水的过程及其平衡常数为:Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)、工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4 , 相应的化学方程式为;I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
(5)、在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1 , 反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。A、适当提高反应温度 B、改变催化剂 C、适当降低反应温度 D、改变反应物浓度
-